Inibição competitiva é a inibição de uma enzima ou receptor pelos chamados antagonistas ou inibidores. São substâncias cuja estrutura química é semelhante à substância do próprio corpo, que se destina a se ligar à estrutura alvo.
Qual é a inibição competitiva?

Várias estruturas na anatomia humana são dotadas de locais de ligação. Essas estruturas incluem, por exemplo, receptores e enzimas. Via de regra, várias substâncias são capazes de se ligar aos locais de ligação dessas estruturas. Se várias substâncias competem pela ligação a uma estrutura anatômica, pode haver inibição competitiva da estrutura alvo.
A bioquímica e a farmacologia conhecem as substâncias concorrentes como agonistas e antagonistas. O agonista é uma substância que ocupa receptores e ativa a transdução de sinal por ligação. Os agonistas são substâncias endógenas ou imitações artificiais de tais substâncias. Em farmacologia, os antagonistas são substâncias que inibem a ação de um agonista.
Quando uma estrutura é inibida pela competição de ligação de agonista e antagonista, há inibição competitiva. Na inibição competitiva, um agonista e um antagonista lutam para ocupar a estrutura alvo. Via de regra, o próprio antagonista não tem efeito bioquímico.
Deve ser feita uma distinção entre a inibição não competitiva e a inibição não competitiva, na qual o inibidor não se liga ao centro da enzima ativa, mas sim se liga a outro local da enzima e, dessa forma, atinge uma mudança na conformação e inativação da enzima.
Função e tarefa
Os agonistas ocupam certos receptores no corpo e formam complexos com eles com certo efeito.Receptores são locais de recepção de estímulos no organismo com uma estrutura específica para ligação a um agonista. A capacidade de ligar receptores e desencadear efeitos é chamada de atividade intrínseca. Os antagonistas de um agonista específico são semelhantes em estrutura química ao agonista e, portanto, ocupam os receptores destinados a ele. No entanto, um complexo antagonista-receptor não desenvolve o efeito pretendido para a ligação agonista-receptor. O efeito do receptor é inibido pela ocupação com um antagonista.
A força dos esforços de ligação entre uma determinada substância e um receptor é chamada de afinidade. Os antagonistas devem ter uma afinidade de ligação mais alta do que o agonista para poder deslocar um agonista de seus receptores. Este princípio segue a lei da ação de massa. Isso significa que, com a mesma afinidade de ligação, o agonista ainda pode ser deslocado se o antagonista estiver presente em uma concentração mais elevada. Os antagonistas não competitivos podem ser substituídos por agonistas mais concentrados. Este princípio não se aplica a antagonistas competitivos. A força de antagonistas competitivos é o chamado valor pA2 e é determinada usando o gráfico de Schild.
A maioria dos antagonistas em farmacologia são fisiológicos, isto é, substâncias endógenas. Além das enzimas, os mediadores e seus antagonistas são usados principalmente em medicamentos atualmente. Por exemplo, a histamina é um hormônio do tecido que media a inflamação. É um agonista fisiológico que se liga a receptores específicos de histamina e causa vermelhidão, inchaço e dor no tecido através da ligação. O efeito fisiologicamente pretendido do complexo agonista-receptor, neste caso, é a reação inflamatória.
A farmacologia se baseia nos anti-H1 como antagonistas da histamina. Essas substâncias são extremamente semelhantes bioquimicamente à histamina e, portanto, são capazes de deslocar a histamina do receptor. Como um complexo antagonista-receptor, esses antagonistas não têm efeito próprio. Os anti-H1 podem prevenir ou pelo menos reduzir a inflamação.
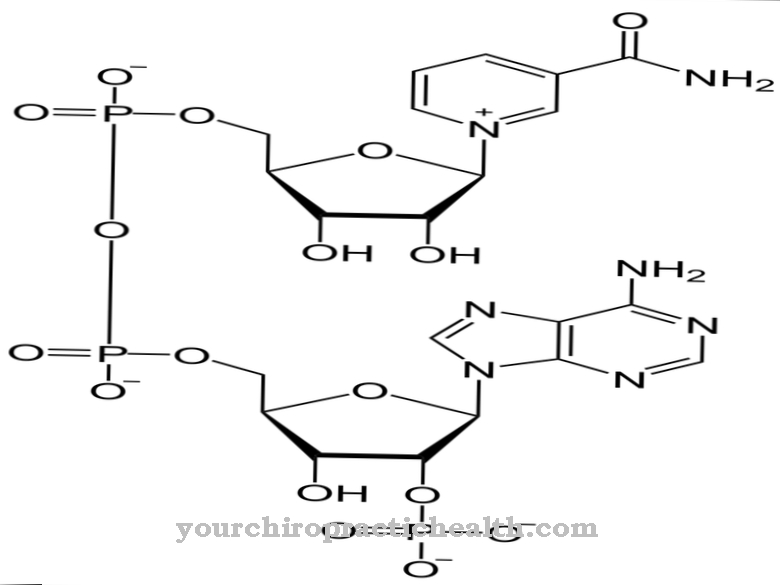
Em relação às enzimas, o medicamento fala de inibidor quando se trata de inibidor, que compete com o substrato pretendido por um centro ativo. A enzima não consegue converter o inibidor e, portanto, deixa de funcionar. A inibição só dura se a concentração do inibidor permanecer suficientemente alta.
Doenças e enfermidades
Os inibidores baseados no princípio da inibição competitiva são usados para tratar vários quadros clínicos. Por exemplo, a terapia de inibição competitiva é amplamente usada no tratamento de ataques agudos de gota. O inibidor NSAID é usado para inibir a síntese de prostaglandinas. Ela inibe a ciclooxigenase, uma enzima envolvida no metabolismo inflamatório. Essa inibição produz um efeito analgésico e antiinflamatório. Os remédios convencionais para a gota aguda são o ibuprofeno ou o diclofenaco.
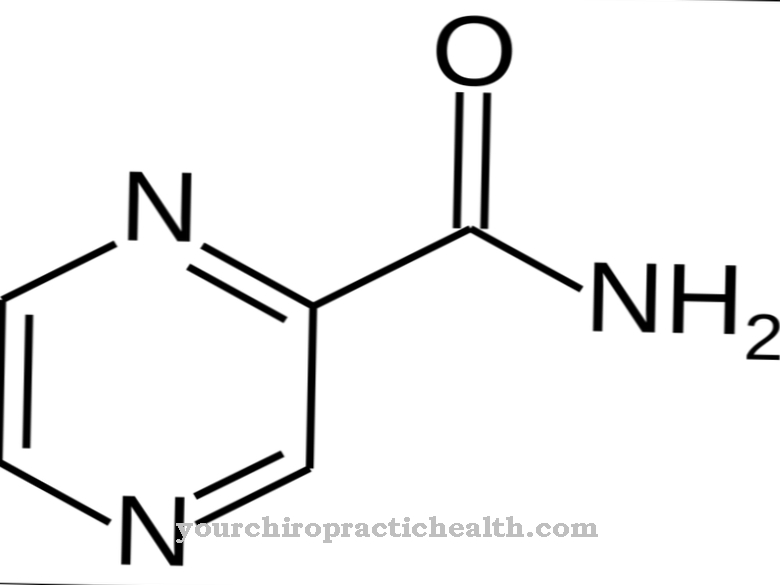
Na gota crônica, os principais inibidores usados são os [[agentes uricostáticos]. Essas substâncias inibem a xantina oxidase. A xantina oxidase oxida a hipoxantina em xantina, que eventualmente se transforma em ácido úrico. A inibição da xantina oxidase reduz a produção de ácido úrico e reduz os sintomas de gota. Ao mesmo tempo, a administração do inibidor aumenta a concentração de hipoxantina no corpo. A síntese de purinas também é inibida de agora em diante.
A inibição competitiva oferece uma vantagem decisiva sobre outros métodos de inibição. O farmacologista diferencia entre inibição reversível e irreversível. No caso de inibição irreversível, ocorre um processo de inibição irreversível. O processo não pode ser revertido mesmo com um agonista mais concentrado. No caso de inibição reversível, entretanto, há reversibilidade. A inibição competitiva pode, portanto, na maioria dos casos, ser cancelada novamente aumentando a concentração do agonista. Este tipo de inibição é, portanto, um dos modos de ação mais importantes das drogas.
O mecanismo de inibição por inibidores não está exclusivamente associado a terapias e sucessos terapêuticos. Por exemplo, a inibição também desempenha um papel no desenvolvimento do câncer. As células tumorais liberam inibidores da apoptose e, assim, aumentam sua vitalidade. Eles resistem às terapias imunológicas e evitam a própria morte celular.


.jpg)




.jpg)




.jpg)
.jpg)
.jpg)


.jpg)