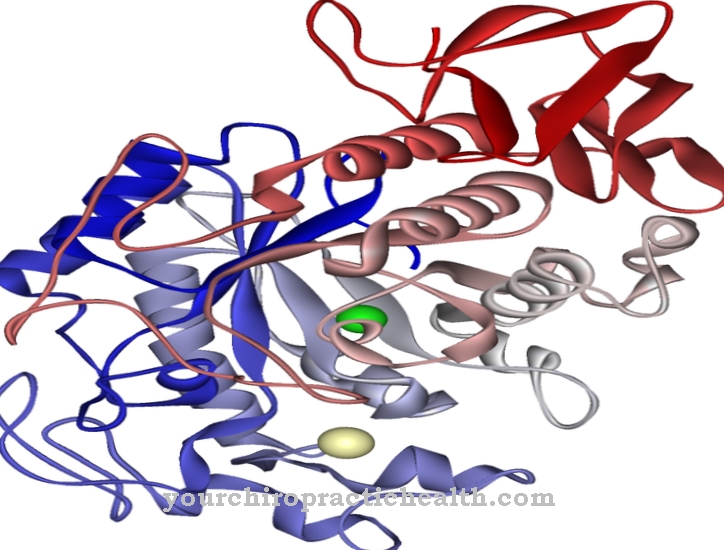
Calcineurina (Pode) é uma proteína fosfatase que desempenha um papel importante na ativação das células T do sistema imunológico, mas também é ativa em outras vias de sinalização mediadas pelo cálcio em todo o corpo. Ao desfosforilar a proteína NF-AT, essa enzima inicia uma série de transcrições de genes que são principalmente responsáveis pelo trabalho característico dos linfócitos T. Graças a essa posição-chave, a calcineurina é o ponto de partida para vários métodos terapêuticos de imunossupressão.
O que é calcineurina?
A enzima é composta por duas subunidades: Calcineurina A (aprox. 60 kDa) cuida da função catalítica e tem um sítio de ligação de calmodulina, enquanto calcineurina B (aprox. 19 kDa) é reguladora ativa e tem dois sítios de ligação de íons de cálcio.
Em seu estado fundamental, o CaN é inativo porque parte da proteína bloqueia o centro ativo - isso é chamado de autoinibição. A ligação da calmodulina ativada pelo cálcio e dos íons cálcio é necessária para a ativação completa. Como uma fosfatase, a calcineurina recebe o número EC 3.1.3.16, que compreende aquelas enzimas que catalisam a desfosforilação hidrolítica de resíduos de serina e treonina de outras proteínas.
Função, efeito e tarefas
O local de ligação do substrato da enzima é seletivo, especialmente para NF-ATc (fator nuclear de células T ativadas, citosólico). Este fator de transcrição é encontrado no plasma celular dos linfócitos. No estado fundamental, o NF-Atc é fosforilado e, portanto, inativo.
O papel da calcineurina na resposta imune começa com a absorção de um antígeno - e. de um vírus, uma bactéria ou componentes de células degeneradas - por uma célula do sistema imunológico (monócitos, macrófagos, células dendríticas e células B). Essa substância é então processada e apresentada na superfície da célula.
Quando as células apresentadoras de antígenos entram em contato com o receptor de células T das células T, uma cascata de sinal é posta em movimento. Esses estímulos extracelulares aumentam a concentração de cálcio na célula. Os íons cálcio estão ligados ao CaN B, que ao alterar a estrutura da proteína dissolve o domínio autoinibitório do CaN A e medeia a ligação da calmodulina ao CaN A. Isso torna a calcineurina totalmente ativa cataliticamente e desfosforila a região rica em serina (SRR) no terminal amino de NF-ATc. Isso resulta em uma mudança conformacional de NF-ATc, como resultado da qual o fator de transcrição é transportado para o núcleo da célula. Lá ele aciona a transcrição de vários genes responsáveis, entre outras coisas, pela produção de interleucinas como a IL-2.
A IL-2 também garante a ativação de células T helper e a síntese de citocinas, direcionando o trabalho das células T citotóxicas. Enquanto as células auxiliares controlam outros linfócitos na resposta imune - e. por maturação de células B em células plasmáticas ou células de memória e ativação de fagócitos - as células T citotóxicas são responsáveis pela destruição de células infectadas ou degeneradas no corpo. Uma vez que esse caminho não pode ser seguido sem calcineurina, a enzima desempenha um papel fundamental na resposta imunológica.
Outras proteínas alvo da enzima são a proteína de ligação ao elemento de resposta cAMP (CREB) com influência, e. no sistema nervoso e no relógio interno e fator 2 potenciador de miócitos (MEF2), que é parcialmente responsável pela diferenciação celular no desenvolvimento embrionário e desempenha um papel na resposta ao estresse de alguns tecidos em adultos.
Educação, ocorrência, propriedades e valores ideais
Existem diferentes isoformas das duas subunidades (CaN A: 3 isoformas, CaN B: 2 isoformas), algumas das quais são expressas de forma diferente dependendo da região do corpo. Em particular, destaca-se o CaN A γ, que ocorre exclusivamente nos testículos e ali está envolvido na maturação das sementes. Apesar do importante papel que desempenha no sistema imunológico e nos nervos, pode-se supor que a calcineurina pode ser encontrada em quase todos os tecidos. A regulação ocorre menos por meio de um aumento ou diminuição da síntese, mas por meio do inibidor da calcineurina CAIN. Isso evita, por exemplo, a desfosforilação de NF-AT.
A regulação de feedback negativo por RCAN1 garante que nenhuma concentração citosólica excessivamente alta de CaN ocorra. O NF-AT ativado (desfosforilado) liga-se ao promotor do gene RCAN1 no núcleo da célula e, assim, dispara a transcrição. O RCAN1 resultante se liga ao CaN e inibe sua atividade.
Doenças e distúrbios
A calcineurina é o alvo dos inibidores da calcineurina, como Ciclosporina, pimecrolimus e tacrolimus. Ao inibir a ação da fosfatase do CaN, é causada uma imunossupressão, que e. após transplantes de órgãos para reduzir a probabilidade de rejeição ou em doenças autoimunes para combater processos inflamatórios.
Assim, os inibidores de CaN também são usados para o tratamento de doenças do grupo reumatoide. Outras abordagens que estão sendo exploradas são o combate à tuberculose, esquizofrenia e diabetes. A presença exclusiva de CaN A γ nos testículos implica um possível papel no desenvolvimento de contraceptivos. Em casos de hipertrofia cardíaca em que a via de sinalização CaN-NA-FT está envolvida, o desenvolvimento de hipertrofia pode ser evitado pela administração de inibidores de CaN.
Pessoas com síndrome de Down têm três cromossomos 21 em vez dos dois habituais, que codificam uma proteína inibidora da calcineurina. Este inibidor impede que a calcineurina interaja com as células dos vasos sanguíneos e desencadeie processos de proliferação nestes. Este fato é particularmente importante no caso dos tumores, pois estes, entre outras coisas, garantem seu suprimento sanguíneo por meio da calcineurina. Intervir neste ponto pode prevenir efetivamente a progressão do câncer. Então você pode encontrar, por exemplo uma incidência significativamente menor de tumores em pessoas com síndrome de Down e espera que a inibição direcionada desse processo forneça vantagens na luta contra o câncer no futuro.
Recentemente, há também evidências crescentes de que a desregulação da calcineurina relacionada à idade também pode desempenhar um papel no desenvolvimento de doenças neuronais, como Alzheimer. A pesquisa sobre as vias de sinalização nas quais a enzima está envolvida revela cada vez mais manchas brancas no mapa bioquímico. Ao mesmo tempo, abre-se a esperança de que, com a ajuda dessa proteína-chave, possamos compreender e tratar melhor um grande número de doenças diferentes no futuro.









.jpg)


.jpg)