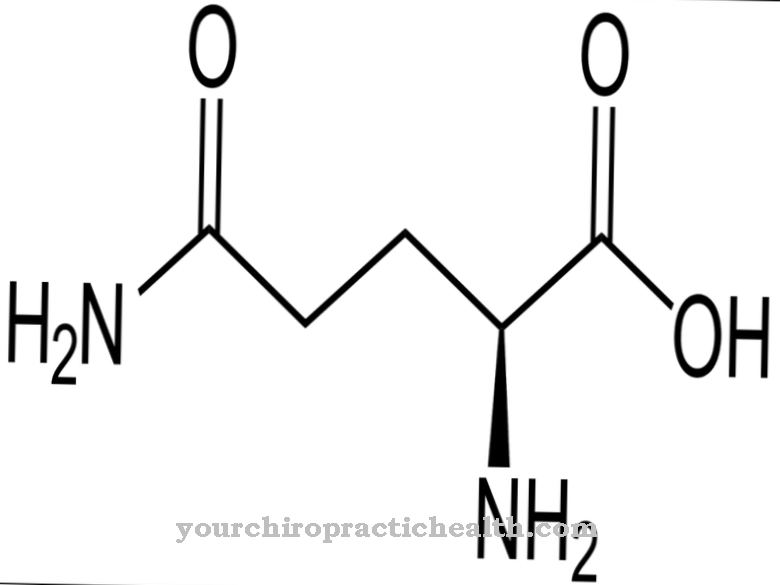
Desmosin é um aminoácido proteinogênico. Juntamente com outros aminoácidos, forma a fibra e a proteína estrutural elastina. Com mutações no gene ELN, a estrutura da elastina é perturbada.
O que é desmosina?
Os aminoácidos são uma parte importante do organismo humano. Eles são uma classe de compostos orgânicos formados por pelo menos um grupo carboxi e um grupo amino. Os aminoácidos são, portanto, tanto ácidos carboxílicos quanto aminas.
Dependendo de sua posição em relação ao grupo carboxi, os aminoácidos podem ser atribuídos a diferentes grupos. Os aminoácidos com um grupo carboxi terminal são chamados geminal ou α e contam entre os α-aminoácidos. Esses aminoácidos são elementos de proteínas. O corpo humano possui mais de 20 aminoácidos proteinogênicos e 400 aminoácidos não proteinogênicos. Os D-aminoácidos são um grupo especial. Um dos mais de 20 aminoácidos proteinogênicos é a desmosina, que junto com a isodesmosina de construção semelhante forma a proteína elastina da fibra.
A elastina e seu precursor solúvel, a tropoelastina, pertencem às proteínas estruturais e contribuem para a formação e retenção de estruturas anatômicas. A elastina desempenha um papel especial na capacidade dos grandes vasos sanguíneos de se esticarem, por exemplo, a aorta.
Função, efeito e tarefas
A desmosina é formalmente um aminoácido quádruplo. Possui um anel de piridínio no centro. A piridina é um composto químico com a fórmula empírica C5H5N, que pode ser atribuído aos sistemas parentais heterocíclicos e forma a azina mais simples na forma de um anel de seis membros com um átomo de nitrogênio e cinco átomos de carbono.
Graças ao seu anel central de piridínio, a desmosina pode formar uma rede de cadeias de proteínas individuais na elastina da proteína da fibra. A composição da elastina é semelhante à do colágeno. Em vez da hidroxilisina, entretanto, a elastina tem uma proporção significativa de valina. Os resíduos de lisina são oxidados a alisina pela enzima lisil oxidase. Três alisinas e uma lisina, por sua vez, formam uma desmosina na forma de um anel. Esta forma desempenha um papel significativo na elasticidade de uma molécula de elastina inteira.
Como uma rede de proteínas, a elastina consiste em unidades ligadas à desmosina e é elasticamente esticável. Tanto os pulmões como a pele e os vasos sanguíneos dependem da elastina e de seu componente desmosina, pois só assim obtêm uma elasticidade considerável. A desmosina fica com uma fluorescência azul sob a luz ultravioleta e dá à elastina sua cor amarela, sua insolubilidade em água, estabilidade ao calor e resistência a álcalis e proteases.
Educação, ocorrência, propriedades e valores ideais
A formação de desmosina também é conhecida como biossíntese de desmosina. Durante esta biossíntese, os grupos amino terminais das unidades de L-lisina são convertidos em ω-aldeídos pela enzima lisil oxidase através da oxidação.
A lisil oxidase é uma proteína lisina 6 oxidase e, portanto, corresponde a uma enzima que ocorre no espaço extracelular do tecido conjuntivo. Na reticulação de elastina e colágeno, atua como um catalisador e estabilizador mecânico para proteínas. Durante a biossíntese da desmosina, a lisil oxidase converte a lisina em alisina. Esse processo ocorre na matriz extracelular e estabiliza as ligações cruzadas entre o colágeno e a elastina.De um ponto de vista químico, a reação corresponde à desaminação oxidativa para formar o aldeído. A alisina forma alisinaldol ou desmosina com resíduos de aldeído de moléculas de tropelastina vizinhas por meio de uma condensação de aldol.
A lisina restante forma uma base de Schiff por meio de seu grupo amino e cria a isodesmosina. Além dos vasos sanguíneos, pulmões e pele, todas as microfibrilas, em particular, carregam desmosina. Estas são as menores fibras de tecido colágeno, reticular e elástico.
Doenças e distúrbios
A formação de elastina a partir de componentes como a desmosina é interrompida em várias doenças. Essas doenças incluem principalmente mutações no gene ELN. As mais importantes são a dermatocalase, a síndrome de Williams-Beuren e a estenose aórtica congênita subvalvar. A dermatocalase é um grupo de alterações do tecido conjuntivo com acúmulo familiar.
Característica desse grupo é a pele flácida, menos elástica e enrugada em várias partes do corpo. O gene ELN codifica a elastina e pode causar esses sintomas por meio de uma mutação. A síndrome de Williams-Beuren é bastante rara em comparação com esta, afetando apenas um em cada 20.000 recém-nascidos. A doença é causada por um defeito no cromossomo sete. O locus do gene é 7q11.23. Devido a um defeito neste ponto, a pessoa afetada não possui o gene da elastina e os genes vizinhos. A deleção do gene da elastina causa dismorfismo facial e distúrbios na estrutura do órgão interno. Podem ocorrer defeitos cardíacos, como estenose aórtica supravalvar, e malformações renais, como rim em ferradura ou estenose vascular renal. Além disso, muitas vezes existe uma deficiência cognitiva.
As habilidades mentais das pessoas afetadas estão abaixo da média. Apesar da expressividade verbal, eles geralmente formam frases com pouco conteúdo. Eles começam a ler muito cedo, o que muitas vezes superestima suas habilidades mentais. Além de sua hiperlexia, seu pitch perfeito costuma levar a superestimações. Como uma forma de mutação da elastina, a estenose aórtica congênita subvalvar corresponde, por sua vez, a uma malformação cardíaca associada a um estreitamento da artéria principal. A estenose supravalvar encontra-se sobre a válvula aórtica no início da aorta.
Esta forma de defeito cardíaco é frequentemente caracterizada por constrições em forma de ampulheta que ficam acima da saída dos vasos coronários. A parte ascendente da aorta também pode ser estreitada. Esta forma de estenose aórtica ocorre com particular frequência no contexto da síndrome de Williams-Beuren que acabamos de discutir. Este defeito cardíaco já foi observado independentemente da doença. Nesse caso, entretanto, não precisa necessariamente estar relacionado a uma mutação no gene da elastina.

.jpg)





.jpg)


.jpg)







.jpg)