Miosina pertence às proteínas motoras e é responsável, entre outras coisas, pelos processos envolvidos na contração muscular. Existem diferentes tipos de miosinas, todas as quais participam nos processos de transporte das organelas celulares ou nas mudanças dentro do citoesqueleto. Desvios estruturais na estrutura molecular da miosina podem, em certas circunstâncias, ser a causa de doenças musculares.
O que é miosina?
Junto com a dineína e a cinesina, a miosina é uma das proteínas motoras responsáveis pelos processos de movimento celular e processos de transporte dentro da célula. Em contraste com as outras duas proteínas motoras, a miosina só funciona com a actina. A actina, por sua vez, faz parte do citoesqueleto da célula eucariótica. Portanto, é responsável pela estrutura e estabilidade da célula.
Além disso, a actina com miosina e duas outras proteínas estruturais formam a unidade estrutural contrátil real do músculo. Dois terços das proteínas contráteis no músculo são miosinas e um terço são actina. No entanto, as miosinas não estão presentes apenas nas células musculares, mas também em todas as outras células eucarióticas. Isso se aplica a eucariotos unicelulares, bem como a células vegetais e animais. Os microfilamentos (filamentos de actina) estão envolvidos na estrutura do citoesqueleto em todas as células e, junto com a miosina, controlam as correntes protoplasmáticas.
Anatomia e estrutura
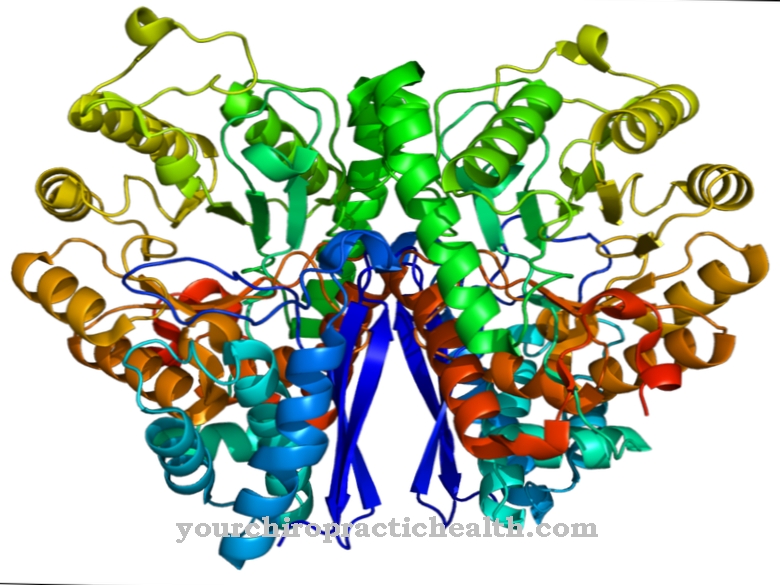
As miosinas podem ser divididas em diferentes classes e subclasses. Existem atualmente mais de 18 classes diferentes conhecidas, sendo as classes I, II e V as mais importantes. A miosina encontrada na fibra muscular é chamada de miosina convencional e pertence à classe 2. A estrutura de todas as miosinas é semelhante. Todos eles consistem em uma parte da cabeça (cabeça de miosina), uma parte do pescoço e uma parte da cauda.
Os filamentos de miosina do músculo esquelético consistem em cerca de 200 moléculas de miosina II, cada uma com peso molecular de 500 kDa. A cabeceira da cama é geneticamente muito conservadora. A divisão em classes estruturais é determinada principalmente pela variabilidade genética da cauda. A parte da cabeça se liga à molécula de actina, enquanto a parte do pescoço atua como uma dobradiça. As partes da cauda de várias moléculas de miosina se acumulam e formam filamentos (feixes). A molécula de miosina II consiste em duas cadeias pesadas e quatro leves.
As duas cadeias pesadas formam um chamado dímero. A mais longa das duas cadeias tem uma estrutura em hélice alfa e é composta por 1300 aminoácidos. A cadeia mais curta é composta por 800 aminoácidos e representa o chamado domínio motor, formando a cabeça da molécula, responsável pelos movimentos e processos de transporte. As quatro cadeias leves são conectadas à cabeça e ao pescoço das cadeias pesadas. As cadeias leves mais distantes da cabeça são referidas como reguladoras e as cadeias leves próximas à cabeça como cadeias essenciais. Eles são muito afins ao cálcio e, portanto, podem controlar a mobilidade da parte do pescoço.
Função e tarefas
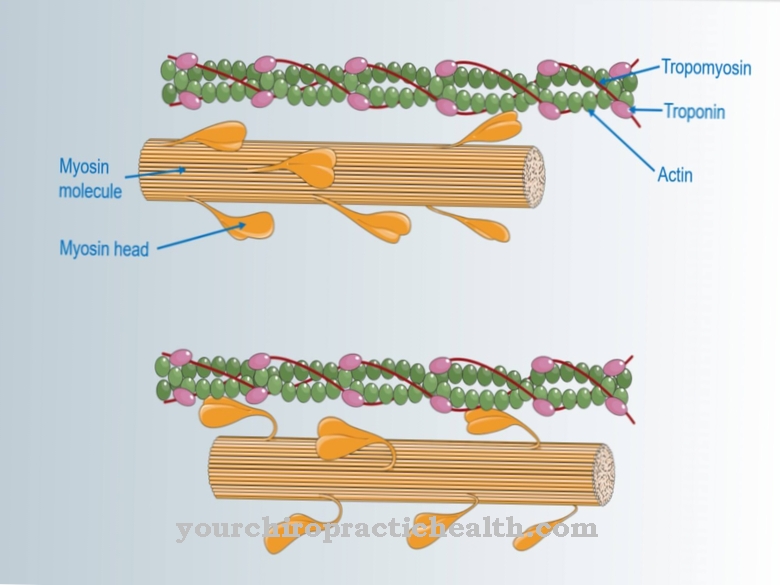
A função mais importante de todas as miosinas é transportar organelas celulares em células eucarióticas e realizar mudanças dentro do citoesqueleto. As moléculas convencionais de miosina II, juntamente com a actina e as proteínas tropomiosina e troponina, são responsáveis pela contração muscular. Para fazer isso, a miosina é primeiro integrada nos discos Z do sacômero usando a proteína titina. Seis filamentos de titina fixam um filamento de miosina.
No sacômero, um filamento de miosina forma cerca de 100 conexões cruzadas para os lados. Dependendo da estrutura das moléculas de miosina e do conteúdo de mioglobina, várias formas de fibras musculares podem ser distinguidas. A contração muscular ocorre dentro do sacômero devido ao movimento da miosina no ciclo da ponte cruzada. Em primeiro lugar, a cabeça da miosina está firmemente ligada à molécula de actina. Em seguida, o ATP é dividido em ADP, pelo qual a energia liberada leva à tensão da cabeça de miosina. Ao mesmo tempo, as cadeias leves garantem um aumento dos íons de cálcio. Isso faz com que a cabeça da miosina se fixe a uma molécula de actina vizinha como resultado de uma mudança conformacional.
Ao liberar a velha conexão, a tensão agora é convertida em energia mecânica por um chamado impacto de força. O movimento é semelhante a uma batida do remo. A cabeça da miosina inclina-se de 90 graus a entre 40 e 50 graus. O resultado é o movimento muscular. Durante a contração muscular, apenas o comprimento do sacômero é encurtado, enquanto os comprimentos dos filamentos de actina e miosina permanecem os mesmos. O suprimento de ATP no músculo é suficiente apenas por cerca de três segundos. Ao quebrar a glicose e a gordura, o ADP é convertido de volta em ATP para que a energia química ainda possa ser convertida em energia mecânica.
Doenças
Mudanças estruturais na miosina causadas por mutações podem levar a doenças musculares. Um exemplo de tal doença é a cardiomiopatia hipertrófica familiar. A cardiomiopatia hipertrófica familiar é uma doença hereditária herdada como traço autossômico dominante. A doença é caracterizada por um espessamento do ventrículo esquerdo sem dilatação.
Com uma prevalência de 0,2 por cento na população em geral, é uma doença cardíaca relativamente comum. Esta doença é causada por mutações que levam a mudanças estruturais na betamiosina e na alfatropomiosina. Esta não é uma, mas várias mutações pontuais das proteínas envolvidas na estrutura do sacômero. A maioria das mutações está localizada no cromossomo 14. Patologicamente, a doença se manifesta como um espessamento dos músculos do ventrículo esquerdo.
Essa assimetria na espessura do miocárdio pode levar a queixas cardiovasculares com arritmias cardíacas, falta de ar, tontura, perda de consciência e angina de peito. Embora muitos pacientes tenham pouco ou nenhum comprometimento da função cardíaca, pode ocorrer insuficiência cardíaca progressiva.

.jpg)


.jpg)


.jpg)

.jpg)

.jpg)
