o catálise corresponde à redução da energia de ativação necessária para as reações químicas e biológicas. A redução catalítica na quantidade de energia necessária é possibilitada por um catalisador que corresponde a uma enzima em biologia. Em doenças enzimáticas, as propriedades catalíticas das enzimas podem ser reduzidas ou mesmo abolidas.
O que é catálise?

As enzimas têm tarefas especiais no corpo humano. Por mais diferente que seja a função das enzimas individuais, elas basicamente têm a mesma tarefa e têm propriedades semelhantes para cumprir essa tarefa. A principal tarefa de todas as enzimas é a catálise. Portanto, a bioquímica diz que eles têm propriedades catalíticas.
Traduzido literalmente, catálise significa "dissolução". O foco da catálise é a energia de ativação. Como tal, a química descreve a quantidade de energia que é absolutamente necessária em um sistema de reação para a reação química de ambos os parceiros de reação. Catalisadores são usados para reduzir a energia de ativação e, assim, permitir que ambos os reagentes reajam no sistema de reação, mesmo com baixas energias. Em sistemas de reação biológica, as enzimas com propriedades catalíticas reduzem a energia de ativação de uma determinada reação química e, portanto, funcionam como catalisadores químicos.
No contexto de uma catálise, por um lado, a probabilidade de um processo de reação bem-sucedido aumenta e, por outro lado, a velocidade da reação às vezes aumenta. Uma mudança no equilíbrio químico não ocorre no contexto da catálise.
A química distingue a catálise homogênea da catálise heterogênea. A biocatálise não corresponde a uma nem a outra forma. É uma forma independente de catálise.
Função e tarefa
Biocatálise corresponde ao controle, implementação ou aceleração de reações químicas em um ambiente biológico. As enzimas atuam como catalisadores biológicos neste processo. Cada enzima consiste principalmente em proteínas, algumas das quais estão associadas a um cofator. Quase todas as reações bioquímicas em organismos vivos têm um catalisador enzimático.
A biocatálise é implementada em biotecnologia usando enzimas isoladas ou vivas. Um exemplo de biocatálise pode ser encontrado em cervejarias, onde processos biocatalíticos são implementados usando bactérias, fungos ou leveduras. A indústria farmacêutica usa a biocatálise para obter reações inviáveis de outra forma.
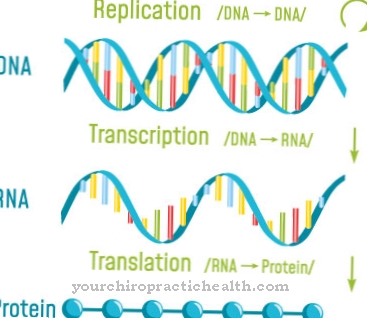
No corpo humano, a catálise ocorre constantemente, na qual as enzimas aceleram certas reações. As enzimas são relevantes para o metabolismo dos organismos, por exemplo, e controlam amplamente as reações bioquímicas nos processos metabólicos. Eles controlam a digestão, por exemplo, mas também estão envolvidos na transcrição e replicação do DNA na forma de polimerases.
A maioria de todas as reações bioquímicas ocorreria em um organismo vivo sem enzimas em uma taxa desprezivelmente lenta. As enzimas aceleram a obtenção do equilíbrio químico sem alterar nada no equilíbrio.
Uma enzima tem atividade catalítica porque pode diminuir a energia de ativação em reações químicas. Essa energia corresponde à quantidade de energia que deve ser aplicada com antecedência para iniciar uma reação. Durante a reação, o substrato muda para estados de transição desfavoráveis energeticamente. A energia de ativação força o substrato em seu estado de transição. O efeito catalítico das enzimas intervém neste ponto da reação, estabilizando o estado de transição do substrato por meio de interações não covalentes. Desta forma, significativamente menos energia é necessária para converter um substrato no estado de transição. Por causa disso, o substrato se converte no produto final da reação em uma taxa mais rápida. Com essas funções catalíticas, as enzimas são consideradas os elementos pioneiros para todo produto de reação bioquímica.
Doenças e enfermidades
Se as enzimas sofrerem mutação ou deixarem de desempenhar seu papel catalítico de maneira adequada por outras razões, haverá grandes consequências para a saúde. O grupo de doenças metabólicas inclui vários distúrbios da área do metabolismo operacional intermediário. Esses distúrbios são congênitos ou adquiridos.
As doenças metabólicas variam muito em extensão e disseminação. Clinicamente, também se manifestam de maneira muito heterogênea. Um distúrbio relacionado é, por exemplo, a doença disseminada diabetes mellitus. No entanto, doenças hereditárias muito mais raras com curso letal também se enquadram neste grupo de doenças. A osteopenia e a osteoporose resultante também podem ser atribuídas a doenças metabólicas.
A maioria das doenças congênitas do grupo superordenado de doenças metabólicas corresponde a defeitos genéticos em várias enzimas. Dependendo da enzima em questão, sua função catalítica e seu produto de reação, defeitos enzimáticos ou deficiências enzimáticas podem, por exemplo, causar a falência de órgãos.
A doença de Gaucher é uma doença metabólica hereditária e relativamente rara. No contexto desta doença, a enzima afetada é a glucocerebrosidase ou glucocerebrosidase. Esta enzima decompõe componentes envelhecidos da membrana celular em um organismo saudável. A doença de Gaucher é deficiente nesta importante enzima. Se a enzima não mostra atividade suficiente, trata-se da deposição de componentes da membrana dentro dos lisossomas. Mais de 200 mutações da enzima foram documentadas até agora no contexto da doença de Gaucher. O grau de atividade enzimática residual depende da mutação do gene codificador no caso individual. A doença pode, por exemplo, fazer com que a enzima falhe completamente. No entanto, uma redução funcionalmente fraca na atividade enzimática também é concebível. A maioria dos pacientes com a doença apresenta manifestações tanto dos órgãos internos quanto do sistema nervoso.








.jpg)


.jpg)

.jpg)

.jpg)
