o Enteropeptidase é uma enzima da mucosa duodenal cuja função é ativar as enzimas pancreáticas. Ele está no início de uma cascata de ativação de enzimas digestivas. A disfunção da enteropeptidase leva à má digestão e má absorção de alimentos no intestino delgado.
O que é uma enteropeptidase?
Enteropeptidase é uma enzima da mucosa duodenal, que ativa as enzimas digestivas do pâncreas ao ativar o tripsinogênio em tripsina.
A enteropeptidase é secretada na borda em escova da mucosa duodenal. Especificamente, as glândulas de Liebekühn são responsáveis pela secreção. As glândulas de Liebekühn são depressões tubulares no epitélio do intestino delgado e grosso. No intestino delgado, eles estão localizados entre as vilosidades do intestino delgado. As glândulas, também conhecidas como criptas de Lieberkühn, secretam um grande número de enzimas além da enteropeptidase. A secreção de enteropeptidase é estimulada quando o quimo, que foi pré-digerido no estômago, entra no duodeno. A enzima por si só não afeta os componentes dos alimentos.
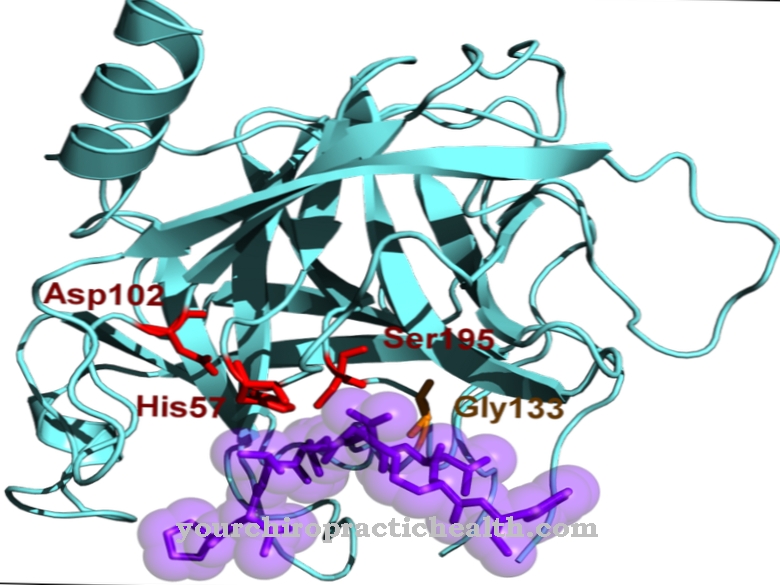
Somente a ativação da enzima tripsina coloca em movimento toda a cascata de ativação das enzimas digestivas. A enteropeptidase, como a tripsina e as outras proteases do pâncreas, é uma serina protease. O centro ativo contém a tríade catalítica de ácido aspártico, histidina e serina. Como uma endopeptidase, a enteropeptidase apenas cliva as proteínas em certos pontos característicos com certos motivos de reconhecimento na sequência de aminoácidos. A enzima sempre cliva no motivo de reconhecimento Asp-Asp-Asp-Asp-Lys. Com o tripsinogênio, o hexapeptídeo Val- (Asp) 4-Lys é clivado, com a formação de tripsina.
Função, efeito e tarefas
A função da enteropeptidase é ativar as enzimas digestivas do pâncreas. Ele apenas inicia a primeira etapa de ativação com a conversão do tripsinogênio em tripsina.
A tripsina é, por sua vez, uma serina protease que cliva proteínas com base no mesmo motivo de reconhecimento característico. Agora, continua a ativação do próprio tripsinogênio. Ao mesmo tempo, ativa outras enzimas pancreáticas de seus respectivos precursores, como quimiotripsinogênio, pró-elastase, pró-carboxipeptidase, pró-fosfolipase e proenteropeptidase. A enteropeptidase também está inicialmente na proforma inativa. Quando o quimo entra no duodeno, não apenas a proenteropeptidase, mas também a duodenase é secretada, o que ativa a proforma da enteropeptidase. Após o início da cascata de ativação, a tripsina assume a ativação de todas as enzimas pancreáticas, incluindo a proenteropeptidase e o tripsinogênio.
A ativação da proenteropeptidase em enteropeptidase ocorre de forma ainda mais eficaz por meio da ação da tripsina do que pela duodenase. A presença primária das enzimas digestivas em sua forma inativa é extremamente importante. A ação das proteases em particular é inespecífica. Todas as proteínas que contêm o motivo de reconhecimento característico dentro da molécula são clivadas hidroliticamente. Se as enzimas fossem cataliticamente ativas imediatamente, as proteínas do próprio corpo já seriam digeridas no pâncreas e no ducto pancreático. Como resultado, o pâncreas se dissolveria. A ativação ocorre apenas no duodeno, fora das glândulas exócrinas.
As enzimas podem começar aqui a quebrar os componentes dos alimentos sem atacar os próprios tecidos do corpo. Para evitar que as enzimas sejam ativadas prematuramente, um inibidor de tripsina adicional atua no ducto do pâncreas. No entanto, o papel fundamental para a cascata digestiva é desempenhado pela tripsina. Uma vez que esta enzima é ativada, a ativação de todas as enzimas digestivas, incluindo a enteropeptidase, não pode ser interrompida.
Educação, ocorrência, propriedades e valores ideais
Como todas as serina proteases, a enteropeptidase também tem um efeito não específico e cliva as proteínas usando um motivo de reconhecimento característico. A enteropeptidase consiste em uma cadeia leve e outra pesada que estão ligadas por pontes dissulfeto. O domínio da serina protease está localizado na cadeia leve.
A cadeia pesada tem uma massa molecular de 82 a 140 kilodaltons, com a massa molecular da cadeia leve sendo de 35 a 62 kilodaltons. A estrutura da cadeia leve da enteropeptidase é semelhante às outras serina proteases tripsina e quimiotripsina. A cadeia pesada é ligada à membrana e influencia a especificidade da enzima. Verificou-se que a cadeia leve isolada tem um efeito semelhante contra o motivo de reconhecimento característico - (Asp) 4-Lys-, mas um efeito significativamente menor contra o tripsinogênio.
Doenças e distúrbios
A enteropeptidase humana é codificada pelo gene ENTK no cromossomo 21. Uma mutação desse gene pode levar a doenças graves nas crianças afetadas.
A enzima não pode mais ativar as outras enzimas digestivas. Os componentes dos alimentos não são mais decompostos e, portanto, não podem mais ser absorvidos pelo intestino delgado. É principalmente uma questão de má digestão (decomposição insuficiente), que leva à má absorção dos componentes dos alimentos. O corpo não é mais fornecido adequadamente com nutrientes. A deficiência de crescimento, o crescimento atrofiado e os sintomas típicos de deficiência de proteína ocorrem com o desenvolvimento de edema. Ao mesmo tempo, além das proteínas, os carboidratos e as gorduras são mal absorvidos. Uma vez que os componentes dos alimentos não digeridos entram no intestino grosso e são decompostos por fermentação e bactérias putrefativas, também ocorrem flatulência, diarréia e dor abdominal.
Até o momento, 15 casos de deficiência congênita de enteropeptidase foram descritos em todo o mundo. No entanto, os sintomas da doença são muito mais comuns. Uma deficiência de enteropeptidase nem sempre precisa estar presente. Como a tripsina desempenha um papel fundamental na ativação de enzimas digestivas, um defeito ou deficiência de tripsina também leva a sintomas semelhantes. O tratamento dessas doenças é o mesmo em ambos os casos. As enzimas são administradas na forma ativada. Certamente existem muitos mais casos não diagnosticados de deficiência de enteropeptidase.
Se o diagnóstico for certo, a enteropeptidase também pode ser substituída. Uma deficiência de enteropeptidase também é desencadeada secundariamente por doenças intestinais graves.Doenças como doença celíaca, intestino delgado encurtado, deficiência de lactase ou outras devem ser esclarecidas no diagnóstico diferencial.

.jpg)

.jpg)


.jpg)




.jpg)

.jpg)

.jpg)
