Cerca de metade de todas as proteínas estão no corpo humano Glicoproteínas. As substâncias desempenham um papel como componentes celulares e também como substâncias imunológicas. Eles são formados principalmente como parte da chamada N-glicosilação e podem causar doenças graves se não forem montados corretamente.
O que são glicoproteínas?
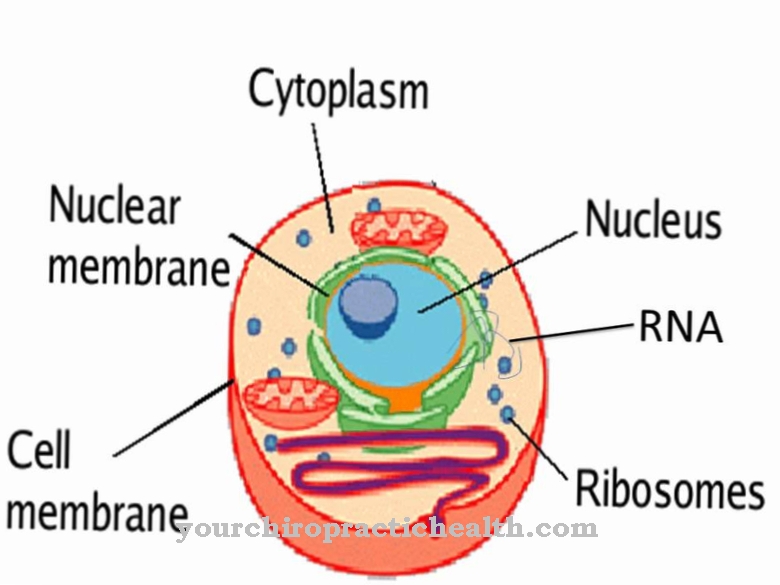
Glicoproteínas são proteínas com resíduos de heteroglicanos ramificados semelhantes a árvores. Geralmente são de consistência viscosa. As macromoléculas contêm grupos de açúcares covalentemente ligados.
Eles consistem em monossacarídeos como glicose, frutose, manose ou amino açúcar acetilado. É por isso que eles também são conhecidos como oligossacarídeos ligados a proteínas. A ligação covalente pode ocorrer de diferentes maneiras e corresponde a uma ligação aos aminoácidos serina ou asparagina. A ligação à serina é chamada de O- e a da asparagina N-glicosilação. As glicoproteínas envolvidas na N-glicosilação variam em tamanho. Eles correspondem a monossacarídeos, di- ou oligossacarídeos e até polissacarídeos.
De acordo com sua proporção de monossacarídeos, eles são divididos em glicoproteínas de alta manose, complexas e híbridas. No grupo rico em manose, os resíduos de manose predominam. No grupo complexo, os sacarídeos predominam. O grupo híbrido é um híbrido. O conteúdo de carboidratos das glicoproteínas está entre alguns por cento para ribonucleases e até 85 por cento para antígenos de grupos sanguíneos.
Função, efeito e tarefas
As glicoproteínas cumprem inúmeras funções no organismo humano. Elas são um componente estrutural das membranas celulares e também são chamadas de proteínas estruturais neste contexto. Eles também são encontrados no muco e são usados como lubrificantes em líquidos.
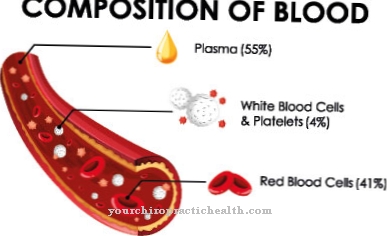
Como proteínas de membrana, contribuem para a interação celular. Algumas glicoproteínas também têm funções hormonais, como o fator de crescimento hCG. As substâncias são tão importantes quanto os componentes imunológicos na forma de imunoglobulinas e interferons. Todas as proteínas de exportação e proteínas de membrana do corpo ainda eram glicoproteínas, pelo menos durante a biossíntese. São particularmente relevantes para as reações de reconhecimento no sistema imunológico, visto que interagem com células T imunológicas e receptores de células T. Várias proteínas plasmáticas foram isoladas no plasma sanguíneo humano, das quais apenas albumina e pré-albumina não possuem resíduos de açúcar.
A abundância de glicoproteínas é incrível. Em última análise, quase todas as proteínas e enzimas solúveis extracelularmente contêm resíduos de açúcar. Como hormônios, as glicoproteínas têm efeito pleiotrópico e, portanto, são cruciais para a atividade de vários sistemas orgânicos. Os hormônios TSH, HCG e FSH são, por exemplo, glicoproteínas. Como proteínas de membrana, elas são representadas tanto no papel de receptores quanto de transportadores e estabilizadores. Eles têm um efeito estabilizador, especialmente junto com os glicolipídeos. Junto com essas substâncias, eles formam o chamado glicocálice, que estabiliza as células sem parede celular.
Educação, ocorrência, propriedades e valores ideais
A formação mais comum de glicoproteínas é a ligação N-glicosídica ou N-glicosilação em asparagina. O açúcar liga-se aos grupos amida de ácido livre de nitrogênio. A N-glicosilação ocorre no retículo endoplasmático. Os N-glicosídeos assim formados são o grupo de glicoproteínas mais relevante.
Na N-glicosilação, o precursor do açúcar se niqueta na molécula transportadora dolicol, independentemente da sequência de aminoácidos da proteína alvo. O grupo OH no final da molécula está ligado ao difosfato. Um precursor de oligossacarídeo é formado no resíduo de fosfato terminal das moléculas. Os primeiros sete açúcares se agrupam no lado citosólico. Duas N-acetil-glucosaminas e cinco resíduos de manose estão ligados ao fosfato de dolicol. Os nucleotídeos de açúcar GDP-manose e UDP-N-acetil-glucosamina aparecem como doadores. O precursor é transportado através da membrana ER por meio de uma proteína de transporte.
O precursor é então orientado para o interior do retículo endoplasmático, onde quatro resíduos de manose são adicionados a ele. Além disso, os resíduos de glicose são cultivados. O precursor de 14 açúcares é finalmente transferido para uma proteína. Outra via de formação de glicoproteínas é a ligação O-glicosídica ou O-glicosilação em serina, que ocorre no aparelho de Golgi das células. O açúcar está ligado a um grupo hidroxila da serina. Os valores das glicoproteínas são particularmente relevantes em relação às proteínas plasmáticas, pois desempenham um papel no hemograma completo. Listar todos os valores normais para glicoproteínas individualmente neste ponto iria além do escopo.
Doenças e distúrbios
Algumas doenças genéticas têm efeitos na glicosilação. Um grupo dessas doenças é o CDG. As glicoproteínas apresentam valores anormais. As pessoas afetadas sofrem de desenvolvimento lento, que se relaciona com problemas físicos e mentais.
Estrabismo pode ser outro sintoma da doença genética. Um total de cerca de 250 genes diferentes estão envolvidos na formação de glocoproteínas. No caso de distúrbios de glicosilação congênita, distúrbios na ligação das cadeias laterais de carboidratos às proteínas são devidos a uma disposição genética. Na modificação pós-tradução, as proteínas recebem sua funcionalidade total. Nesse processo, quando as enzimas ou proteínas que constroem as cadeias laterais de carboidratos são anormalmente montadas, CDG é criado. A N-glicosilação é mais comumente afetada por distúrbios. Até o momento, foram descobertos cerca de 30 defeitos enzimáticos que têm impacto na N-glicosilação.
Os distúrbios genéticos de O-glicosilação são um pouco mais raros. Eles se manifestam em doenças multissistêmicas neuromusculares, como a síndrome de Walker-Warburg. Como as glicoproteínas desempenham tantas funções no organismo, o quadro clínico é caracterizado por uma variedade de sintomas. Todos os sistemas orgânicos podem ser afetados por distúrbios de glicosilação congênita. Os distúrbios do desenvolvimento psicomotor são o principal sintoma. As anormalidades neurológicas são igualmente comuns. Os distúrbios de coagulação ou distúrbios endócrinos também não são incomuns.





.jpg)



.jpg)
.jpg)