o Xantina oxidase é responsável pela conversão em ácido úrico durante a quebra das purinas. Uma deficiência ou inibição da enzima leva à diminuição dos níveis de ácido úrico no sangue.
O que é xantina oxidase?
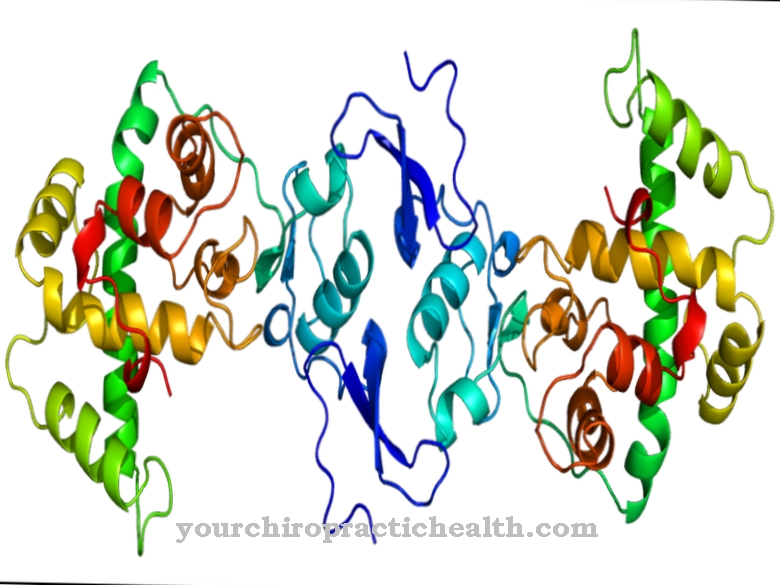
A xantina oxidase é uma enzima que ativa (catalisa) a reação da hipoxantina via xantina ao ácido úrico. Ele contém um componente não protéico como um grupo denominado protético (grego, prótese, anexo), que é responsável pela reatividade.
Este é um derivado da flavina. A xantina oxidase é uma das enzimas da flavina. Ele também tem ferro e molibdênio no centro ativo. Em 1902, a enzima foi descrita pela primeira vez como um componente do leite de vaca pelo bioquímico F. Schardinger, de modo que era anteriormente chamada de enzima de Schardinger. Sob a ação dessa enzima, a cor do corante azul de metileno muda, o que pode ser usado como uma reação de detecção típica para diferenciar entre leite cru e tratado termicamente.
A enzima é destruída em alta temperatura. A mudança na cor se deve ao fato de que as enzimas presentes no leite cru (como a xantina oxidase) na presença de formaldeído descoloram o azul de metileno quando expostas ao ar.
Função, efeito e tarefas
A tarefa mais conhecida da xantina oxidase é a formação de ácido úrico no metabolismo das purinas. As purinas estão presentes em todas as células. Eles fazem parte das bases nucléicas adenosina e guanina, a partir das quais, junto com as bases pirimidínicas citosina e timina (ou uracila), são formados os ácidos nucléicos DNA e RNA.
A informação genética nas diferentes células do corpo consiste em ácidos nucléicos. Isso se aplica a humanos e animais. Por exemplo, pessoas com produtos cárneos ingerem uma grande quantidade na forma de alimentos de origem animal. Se as células do próprio corpo enfraquecem ou se as células animais que entram no corpo através dos alimentos são quebradas, os ácidos nucléicos e, portanto, também as purinas são produzidos. Estes são convertidos em ácido úrico. Sob a ação da xantina oxidase, forma-se inicialmente a hipoxantina e, em uma etapa posterior, a xantina, que é convertida em ácido úrico e pode ser amplamente excretada pelos rins. Apenas uma pequena proporção de ácido úrico sai do corpo pelos intestinos.
Se o corpo acumular grandes quantidades de purina ou tiver sua excreção na urina restrita, o nível de ácido úrico no sangue aumenta. Uma segunda enzima envolvida na degradação das purinas também produz ácido úrico. É chamada de xantina desidrogenase, usa nicotinamida adenina dinucleotídeo (NAD) e é a enzima predominante. Em contraste, a xantina oxidase tem uma subunidade dinucleotídica de flavina adenina (FAD). Se o suprimento for insuficiente, por exemplo, devido à falta de circulação sanguínea, as duas enzimas podem se converter uma na outra.
Quando convertido sob a ação da xantina oxidase, o peróxido de hidrogênio também é formado como subproduto. O peróxido de hidrogênio não é um radical em si, mas é uma substância reativa. É por isso que ele se torna rapidamente inofensivo pela ação de outras enzimas (peroxidase, catalase) no corpo.
Educação, ocorrência, propriedades e valores ideais
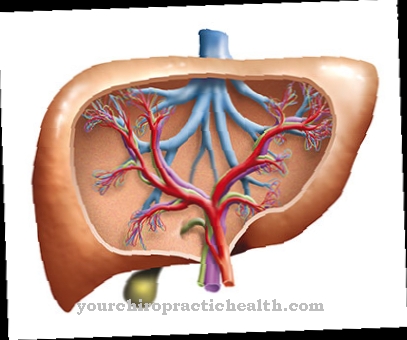
A degradação das purinas ocorre principalmente no fígado. Na membrana mucosa do intestino delgado, a enzima também está envolvida na incorporação de ferro na proteína transportadora transferrina. A pesquisa mostrou que a enzima é encontrada nas células localizadas na parede interna dos vasos sanguíneos. Nesse contexto, discute-se sua influência no curso das doenças cardiovasculares e nos danos causados pelo estresse oxidativo.
A proporção da oxidase em relação à desidrogenase como sistema enzimático responsável pela conversão das purinas em ácido úrico é de 20%. A forma de xantina desidrogenase está 80 por cento presente. A flavina contida na xantina oxidase é uma das riboflavinas, que é idêntica à vitamina B2. A subunidade de molibdênio contida na xantina oxidase é ligada pelo alopurinol, que é muito semelhante em estrutura às purinas. Desta forma, a enzima é quase completamente inibida. A atividade da enzima pode ser determinada indiretamente a partir da quantidade de ácido úrico formado.
Doenças e distúrbios
Com refeições ricas em purinas ou com aumento da morte celular, que ocorre, por exemplo, durante a terapia do câncer, a reação da xantina oxidase é ativada e maiores quantidades de ácido úrico são produzidas. O nível de ácido úrico no sangue aumenta.
Se a enzima for inibida, a concentração de ácido úrico no sangue cai. Esse efeito é a base do medicamento na doença da gota. Na gota, as concentrações aumentadas de ácido úrico levam à cristalização e, portanto, a desconforto nas articulações. Os medicamentos que contêm alopurinol são preparações padrão usadas para tratar a gota. Na forma hereditária de deficiência enzimática, a atividade é reduzida devido a mutações. Esta condição é herdada de forma autossômica recessiva. A criança fica doente se ambos os pais forem portadores de um alelo afetado. Uma atividade reduzida da xantina oxidase também ocorre quando o cofator de molibdênio está faltando porque ele não se formou devido a um defeito.
A xantina e a hipoxantina acumulam-se. Níveis de xantina significativamente aumentados no sangue e o aparecimento de xantina na urina (xantinúria) são perceptíveis nas pessoas afetadas. Ao determinar a xantina para detectar deficiência enzimática, alimentos como grãos de café, chá, mate ou batata devem ser excluídos como fonte de xantina. Os níveis de ácido úrico, por outro lado, são reduzidos. Como a xantina não se decompõe e é moderadamente solúvel, ela pode formar cristais. Na maioria dos casos, a doença não apresenta sintomas. Para outros, entretanto, pode causar problemas renais, infecções do trato urinário ou sangue na urina.
Se os cálculos de xantina se formarem na doença grave, eles podem se depositar no tecido renal ou no trato urinário. As pessoas afetadas devem ter cuidado com uma dieta pobre em purinas e beber muitos líquidos.





.jpg)


.jpg)

.jpg)

.jpg)
