Lisil oxidase é uma enzima do tecido conjuntivo que tem funções catalíticas e promove a reticulação de colágeno e elastina. A enzima tem um efeito estabilizador no tecido conjuntivo ao realizar a desaminação oxidativa e, assim, criar as condições básicas para a reticulação. Em Cutis laxa, a atividade da lisil oxidase é reduzida.
O que é lisil oxidase?
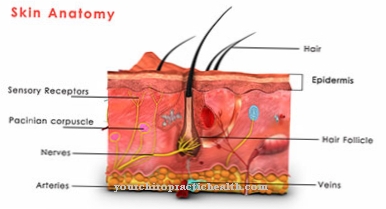
Existem diferentes enzimas no corpo humano, todas com atividade catalítica. As enzimas permitem reações no corpo humano ou as aceleram. A lisil oxidase é uma enzima encontrada no tecido conjuntivo humano. É também chamada de proteína lisina 6 oxidase e é encontrada principalmente no espaço extracelular do tecido conjuntivo.
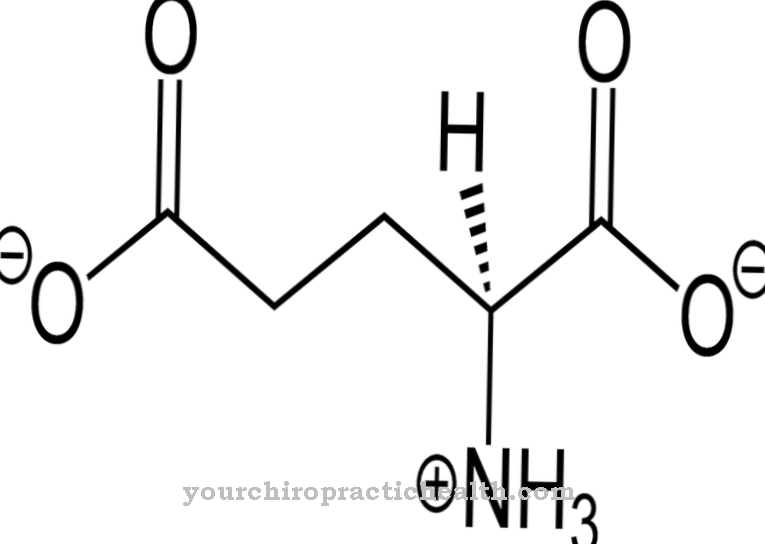
A atividade catalítica da enzima, neste caso, refere-se à reticulação entre o colágeno e a elastina. A lisil oxidase estabiliza as duas proteínas de forma mecânica e, assim, permite a conexão reativa. A lisil oxidase não é encontrada apenas no corpo humano. Outros vertebrados também estão equipados com a enzima. A lisil oxidase é considerada um estabilizador do tecido conjuntivo. Uma deficiência da enzima leva ao quadro clínico de cutis laxa, uma fraqueza grave e hereditária do tecido conjuntivo.
Função, efeito e tarefas
A lisil oxidase assume tarefas importantes no espaço extracelular na conexão cruzada entre as moléculas de colágeno individuais. No corpo humano, o colágeno desempenha um papel importante dentro das proteínas, com cerca de 30% da massa total da proteína.
O colágeno é a proteína mais comum. É uma proteína estrutural e construtiva que compõe muitas partes do corpo, como tecido conjuntivo, ossos, dentes, cartilagem, tendões, ligamentos e pele. A lisil oxidase suporta a ligação do colágeno aos grupos carbonila e, portanto, contribui para a estabilidade dos componentes corporais mencionados. Possui atividade catalítica para a produção de grupos carbonila que formam ligações cruzadas covalentes em colágenos em condensações aldólicas. A tarefa catalítica da lisil oxidase é, portanto, preparar-se para a formação de fibrilas. A enzima cria todas as condições químicas necessárias para a formação.
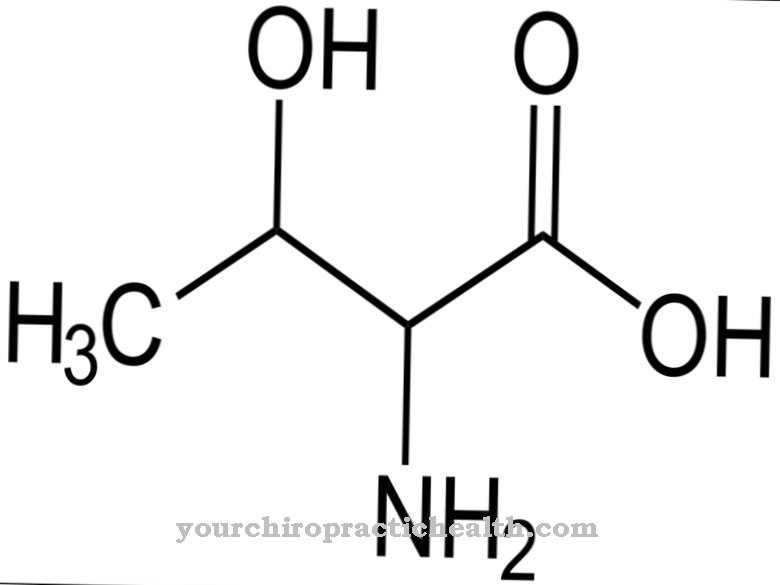
As fibrilas são consideradas fibras de fibra. Eles correspondem a partes finas e fibrosas do corpo e são encontrados nas paredes das células vegetais, nos músculos humanos e no tecido conjuntivo. A tarefa da lisil oxidase neste contexto é essencialmente a desaminação oxidativa dos resíduos lisil. Em química, a desaminação é a separação química de grupos amino como íons de amônia ou amônia. A desaminação oxidativa divide os grupos amino do aminoácido L-glutamato do hidrogênio e os oxida em grupos imino com a transferência do hidrogênio para NAD + ou NADP +.
Isso é seguido pela clivagem hidrolítica de grupos imino como íons amônio, que está associada à formação de α-cetoácido. A desaminação corresponde à primeira etapa da degradação bioquímica dos aminoácidos, que nos mamíferos ocorre principalmente no fígado. O íon amônio formado durante a desaminação é convertido em uréia. Os processos de desaminação da lisil oxidase dão origem a grupos aldeído que, juntamente com os grupos amino individuais de outros resíduos lisilo, dão origem às chamadas bases de Schiff e, deste modo, podem formar as ligações cruzadas estabilizadoras no colagénio.
Educação, ocorrência, propriedades e valores ideais
A lisil oxidase no DNA é codificada pelo gene LOX, que em humanos está localizado no cromossomo 5 no locus gênico q23.3 a q31.2. O produto do gene não é a forma final da enzima. O produto não é uma lisil oxidase acabada, mas uma forma predecessora que, após tradução, tem uma massa molar de 47 kDa.
A glicosilação ocorre no curso posterior. Durante esse processo, a massa molar da última enzima aumenta para 50 kDa e a forma predecessora da lisil oxidase é secretada no espaço extracelular. Após a secreção, a pré-pró-lisil oxidase é processada posteriormente. A substância é dividida no espaço extracelular. A proteína 1 é responsável pela divisão em dois fragmentos, formando assim, por um lado, a lisil oxidase de 32 kDa. Por outro lado, é criada uma substância residual que, neste caso, corresponde a um polipeptídeo.
Doenças e distúrbios
Defeitos genéticos na lisil oxidase podem causar o quadro clínico de cutix laxe. Essa doença também é chamada de dermatocalase e se refere a um grupo de fraquezas do tecido conjuntivo frequentemente relacionadas à idade, que na maioria dos casos são observadas com acúmulo familiar.
A característica comum de todos os fenômenos de dermatocalase é a flacidez e a inelástica pele, que freqüentemente se pendura em grandes dobras em várias partes do corpo. A maioria das pessoas afetadas parece mais velha do que realmente é devido às mudanças. As doenças são causadas, entre outras coisas, por mutações genéticas. Nesse contexto, estamos falando da síndrome da cútis laxa. A doença pode existir nas formas autossômica recessiva, autossômica dominante e cromossômica x. Em muitos casos, a síndrome cutis laxa está associada a outras anomalias e, se os órgãos estiverem envolvidos, por exemplo, pode ser fatal.
ARCL1 corresponde a uma cutis laxa do tipo 1 autossômico recessivo e é considerada a forma mais grave, que em certas circunstâncias pode levar a complicações fatais. A forma ARCL1A está associada a mutações no gene FBLN5 no locus 14q32.12. O tipo ARCL1B está associado a mutações no gene EFEMP2 no locus 11q13.1 e a variante ARCL1C corresponde a uma cutis laxa com anomalias associadas no pulmão, trato gastrointestinal e urinário, que são devido a mutações no gene LTBP4 no locus 19q13.2.
As mutações nos genes mencionados levam a uma atividade abaixo da média da lixiloxidase. Conexões cruzadas inadequadas são criadas devido à atividade reduzida da enzima. O tecido conjuntivo do paciente não está suficientemente estabilizado.





.jpg)


.jpg)


.jpg)