G-CSF é um hormônio peptídico que estimula a formação de granulócitos. Portanto, é de grande importância para o funcionamento do sistema imunológico. O hormônio também é administrado como medicamento a pacientes com sistema imunológico gravemente enfraquecido para estimular a produção de neutrófilos.
O que é G-CSF?
G-CSF é a abreviatura do nome Fator Estimulador de Colônia de Granulócitos. É um hormônio peptídico que estimula a formação de granulócitos a partir de células-tronco pluripotentes. O fator estimulador de colônias de granulócitos pertence às citocinas.
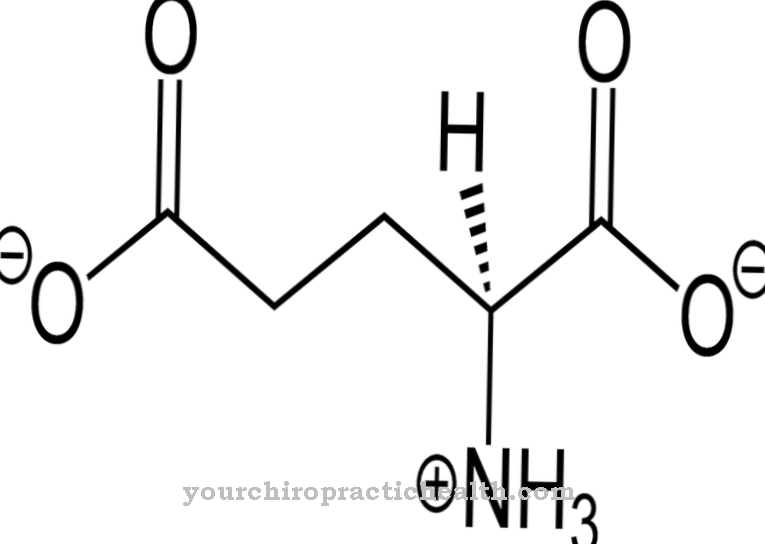
Em geral, as citocinas são proteínas responsáveis pela proliferação de células imunes e, portanto, controlam a resposta imune. Existem diferentes tipos de citocinas. O hormônio peptídico G-CSF é um dos fatores estimuladores de colônias. Quimicamente, o G-CSF humano é uma glicoproteína composta por 174 aminoácidos.Na posição 133 está o aminoácido treonina, que é glicosilado em seu grupo hidroxila. A porção não proteinogênica da molécula no local glicosilado é de aproximadamente quatro por cento do peso molecular. É constituída pelos componentes ácido α-N-acetil-neuramínico, N-acetil-galactosamina e β-galactose.
A glicosilação tem um efeito estabilizador sobre a proteína. Ao mesmo tempo, também desempenha um papel importante em certas funções, como a ativação de granulócitos maduros para combater as fontes atuais de infecção. O G-CSF também contém duas pontes dissulfeto, que determinam a estrutura secundária da proteína. O gene codificador do G-CSF está localizado no cromossomo 17 em humanos.
Função, efeito e tarefas
Como mencionado anteriormente, o G-CSF é um fator importante no sistema imunológico. Estimula as células progenitoras imaturas do sistema formador de sangue (sistema hematopoiético ou pré-CFU) a se diferenciar e proliferar. Isso significa que as células-tronco pluripotentes indiferenciadas sob a influência do G-CSF se diferenciam em granulócitos e se multiplicam por meio da divisão celular.
Os granulócitos são glóbulos brancos neutrofílicos que atuam como os chamados fagócitos. Estes se tornam eficazes quando o organismo é infectado por bactérias. A cada infecção bacteriana, os fagócitos se multiplicam a partir de células progenitoras indiferenciadas. O G-CSF também estimula os granulócitos maduros a se deslocarem para as fontes de infecção para matar as bactérias. Nessa função, a molécula é sustentada por seu resíduo ligado à glicosilação. Na fonte da infecção, o G-CSF pode, assim, aumentar a formação de peróxido de hidrogênio nos granulócitos, o que torna a eliminação de bactérias ainda mais eficaz.
Uma terceira função do G-CSF é fazer com que as células progenitoras hematopoiéticas se desprendam de seu ambiente na medula óssea. Como resultado, algumas dessas células chegam ao sangue periférico. Com a ajuda de novas doses de G-CSF, esse processo pode ser repetido, por meio do qual as células-tronco pluripotentes se acumulam no sangue. Este processo também é conhecido como aférese. A aférese tem se mostrado útil para doadores de células-tronco ou para pacientes expostos a quimioterapia intensa. Dessa forma, os pacientes em quimioterapia podem ter seu próprio sangue enriquecido com células-tronco novamente transplantadas.
Os doadores de células-tronco, por outro lado, podem fazer uma doação de sangue normal em vez de uma doação de medula óssea. O G-CSF, portanto, serve como uma substância medicinal e é usado na neutropenia crônica (redução dos granulócitos neutrófilos), na quimioterapia ou no transplante de células-tronco.
Educação, ocorrência, propriedades e valores ideais
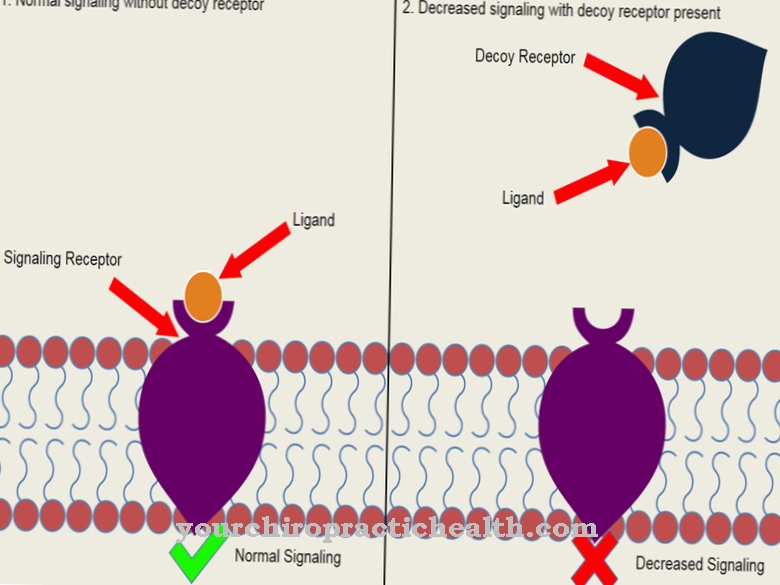
O G-CSF está integrado na complexa rede homeostática do organismo. O fator estimulador de colônias de granulócitos faz parte tanto do sistema imunológico quanto do sistema endócrino. As células-tronco pluripotentes da medula óssea e os granulócitos neutrófilos maduros têm receptores para G-CSF.
Quando necessário, as proteínas do G-CSF se ligam aos receptores e, assim, garantem que seu efeito se desdobre. Cada organismo forma seu próprio G-CSF. No entanto, se a necessidade aumentar, como em infecções graves, quimioterapia ou imunodeficiência geral, o hormônio pode ter que ser injetado por via subcutânea. Os medicamentos mais conhecidos são o pegfilgrastim e o lipegfilgrastim. Estes são produzidos de forma recombinante a partir de certas células de mamíferos, como células CHO (Ovário de Hamster Chinês) ou de Escherichia coli. As sequências de aminoácidos são idênticas em ambas as formas de produção.
Pode haver diferenças na glicosilação. No entanto, produtos mais novos são glicosilados na mesma posição que o G-CSF original. Certas formas de processamento, como a PEGuilação, aumentam a resistência e a meia-vida dos medicamentos quando usados sem alterar sua eficácia. Para este propósito, o G-CSF é quimicamente ligado ao polietilenoglicol.
Doenças e distúrbios
Também pode haver efeitos colaterais ao usar G-CSF. As dores ósseas e musculares são as mais comuns. Isso geralmente é acompanhado por náuseas, vômitos, perda de apetite e diarréia. Também podem ocorrer inflamação das membranas mucosas e perda de cabelo. As queixas são o resultado do aumento da formação de neutrófilos, que desencadeiam reações imunológicas aumentadas.
Infiltrados nos pulmões, que entre outras coisas causam tosse, falta de ar e febre, são observados com menos frequência. Isso pode até levar à chamada Síndrome da Dificuldade Respiratória Aguda (SDRA), que indica uma reação intensa dos pulmões a fatores externos prejudiciais. O baço pode aumentar tanto que se rompe. Outro sintoma é o aumento da leucocitose, ou seja, o aumento da formação de glóbulos brancos. Na presença de anemia falciforme, o G-CSF não deve ser usado porque, de acordo com um estudo americano, podem ocorrer efeitos colaterais graves aqui, alguns dos quais levam até mesmo à falência de múltiplos órgãos.
No entanto, muitos estudos também mostram que os sintomas geralmente são reversíveis. Após a interrupção da terapia com G-CSF, os efeitos colaterais também desaparecem. Embora haja um aumento da formação de neutrófilos durante o tratamento com G-CSF, os estudos até agora não encontraram um risco aumentado de desenvolver leucemia.

.jpg)





.jpg)


.jpg)


.jpg)