o Aldeído oxidase é uma enzima que decompõe aldeídos em vertebrados. Ele pode ser encontrado em diferentes tecidos de mamíferos e humanos. A função exata da aldeído oxidase ainda não é conhecida.
O que é aldeído oxidase?
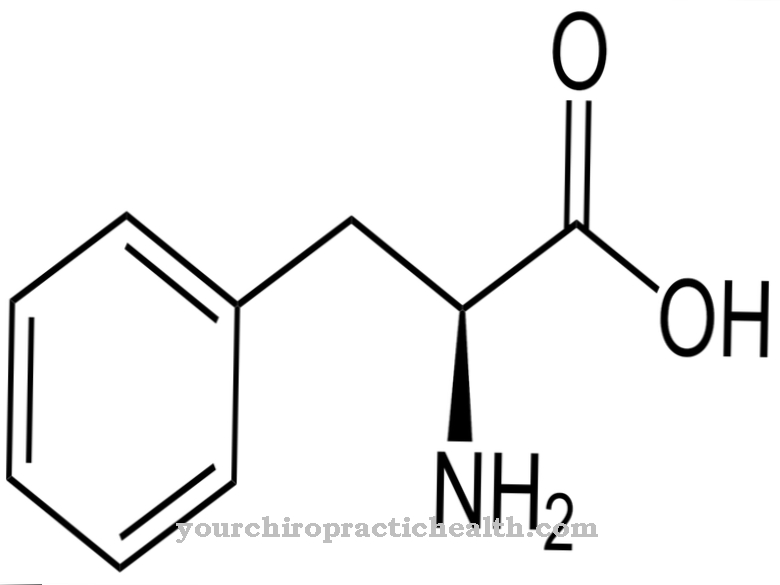
A aldeído oxidase (AOX1) ajuda na degradação enzimática dos aldeídos no corpo. No entanto, verificou-se que também decompõe a nicotina em cotinina. Um átomo de oxigênio é construído na nicotina livre de oxigênio para formar uma estrutura de aldeído.
Devido a este fato, a aldeído oxidase também é importante para o metabolismo do triptofano e ao mesmo tempo para a biotransformação. É encontrada principalmente no citosol das células do fígado, pâncreas, pulmões, músculos esqueléticos ou células de gordura. O cofator molibdênio é muito importante para a atividade da enzima. Existe apenas um gene AOX no DNA humano que pode codificar uma enzima funcional. Vários genes AOX estão ativos em outros vertebrados. A aldeído oxidase é muito semelhante e relacionada à enzima xantina desidrogenase.
Ambas as enzimas podem converter a hipoxantina em xantina, absorvendo um átomo de oxigênio e uma molécula de água. A conversão da xantina em ácido úrico, entretanto, só ocorre por meio da xantina hidrogenase (xantina oxidase). A aldeído oxidase consiste em 1338 aminoácidos. Molibdopterina, FAD e 2 (2Fe2S) servem como cofatores para sua eficácia. A reação já caracterizada pelo nome caracteriza a conversão de aldeídos com adição de oxigênio e água a ácidos carboxílicos e peróxido de hidrogênio.
Função, efeito e tarefas
A enzima aldeído oxidase catalisa várias reações. Na maior parte, é responsável pela conversão de aldeídos em ácidos carboxílicos com a adição de oxigênio e água. Em geral, a aldeído oxidase medeia a adição de um átomo de oxigênio a um substrato.
Entre outras coisas, também catalisa a conversão da nicotina em conitina. Portanto, também desempenha um papel importante na biotransformação e no metabolismo do triptofano. O molibdênio é sempre necessário como co-fator nessas reações. Como parte da biotransformação, ele converte xenobióticos com grupos aldeído nos ácidos carboxílicos correspondentes na fase I da reação. Na reação de fase II, o ácido glucurônico é ligado aos grupos carboxila para aumentar a solubilidade em água, a fim de expulsar a molécula estranha do corpo.
Estrutural e quimicamente, a aldeído oxidase está intimamente relacionada à enzima homóloga xantina hidrogenase (xantina oxidase). No entanto, não se sabe por que a conversão da xantina em ácido úrico com a adição de oxigênio e água é catalisada apenas pela xantina oxidase. A conversão de hipoxantina em xantina ainda é catalisada por ambas as enzimas. Além disso, a aldeído oxidase também é responsável pela adipogênese (reprodução das células de gordura).
Estimula a secreção do hormônio tecidual adiponectina. A adiponectina, por sua vez, aumenta a eficácia da insulina. Nos hepatócitos, a adiponectina, por sua vez, inibe a liberação da aldeído oxidase. A deficiência de aldeído oxidase (AOX1) também inibe a exportação de lipídios das células. A função exata da aldeído oxidase ainda não é totalmente compreendida.
Educação, ocorrência, propriedades e valores ideais
A aldeído oxidase é encontrada principalmente no citoplasma das células do fígado. No entanto, também é encontrado nas células de gordura, tecido pulmonar, músculos esqueléticos e pâncreas. Costumava ser confundida com a xantina oxidase homóloga.
Ambas as enzimas têm uma estrutura semelhante. No entanto, às vezes eles catalisam reações diferentes. Ambas as enzimas precisam dos mesmos cofatores para sua função. Estes são molibdopterina, FAD e 2 (2Fe2S). No entanto, a aldeído oxidase não só degrada os aldeídos, mas também é responsável pela oxidação de compostos N-heterocíclicos, como a nicotina, a cotinina.
Doenças e distúrbios
Juntamente com a xantina desidrogenase (xantina oxidase) e a sulfito oxidase, a aldeído oxidase é dependente do cofator molibdênio. O molibdênio é construído em uma molibdopterina como um átomo complexo e forma o cofator de molibdênio. No caso de deficiência de molibdênio, essas três enzimas funcionam mal.
A xantina desidrogenase catalisa a degradação da xantina em ácido úrico. A enzima aldeído oxidase está apenas parcialmente envolvida neste processo, por exemplo, quando a hipoxantina é decomposta em xantina. Aqui, ele até compete com a xantina oxidase. Portanto, não há deficiência isolada de aldeído oxidase. No entanto, a aldeído oxidase auxilia na degradação das catecolaminas. A sulfito oxidase é responsável pela quebra de aminoácidos contendo enxofre, como cisteína, taurina ou metionina. Se essa enzima for deficiente, o sulfito não será mais convertido em sulfato. Por causa do cofator molibdênio, as três enzimas geralmente têm uma deficiência comum.
Claro, defeitos isolados devido a mutações são possíveis para cada uma dessas enzimas. No entanto, nenhum quadro clínico com deficiência específica de aldeído oxidase foi descrito até o momento. A deficiência de molibdênio induzida por uma dieta desequilibrada é muito rara. No entanto, isso pode acontecer com a nutrição parenteral com baixo teor de molibdênio por mais de seis meses. Nesses casos, taquipneia, taquicardia, cefaleia intensa, náuseas, vômitos, obstrução facial central ou coma são comuns. Além disso, existem intolerâncias a certos aminoácidos. Concentrações elevadas de sulfito são encontradas na urina, enquanto valores reduzidos de ácido úrico são encontrados no sangue.
Se a deficiência de molibdênio persistir, pode levar a problemas com a quebra de aminoácidos contendo enxofre, alergias a sulfito, queda de cabelo, níveis baixos de ácido úrico no sangue e problemas de fertilidade. A maioria dos sintomas, entretanto, deve-se à deficiência de sulfito oxidase e xantina desidrogenase. A taquicardia provavelmente se deve ao aumento dos níveis de adrenalina ou noradrenalina (catecolaminas), pois sua degradação é retardada pela falta de aldeído oxidase. A deficiência de molibdênio pode ser causada por uma dieta extremamente pobre em molibdênio e em doenças inflamatórias intestinais, como a doença de Crohn com má absorção de alimentos.
Uma deficiência hereditária do cofator de molibdênio devido à síntese prejudicada de molibdopterina é fatal se todas as três enzimas falharem sem tratamento.




.jpg)


.jpg)

.jpg)

.jpg)
