Transtiretina é uma proteína transportadora dos hormônios da tireoide encontrada em todos os vertebrados. É sintetizada no fígado e em certas áreas do cérebro. Mudanças genéticas específicas na transtirretina podem causar amiloidose tipo 1 ou amiloidose ATTR.
O que é transtiretina?
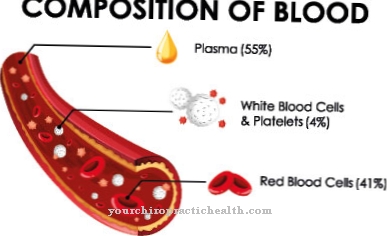
Transtiretina (TTR) pertence às proteínas de transporte. Além da globulina ligadora de tiroxina (TBG), também é uma proteína que se liga aos hormônios da tireoide. No entanto, sua força de ligação não é tão forte quanto a do TBG.
L-tiroxina (T4) é 99,99 por cento e triiodotironina (T3) pelo menos 99 por cento ligado a TBG. A transtirretina liga-se ao hormônio tireoidiano T4 com menor afinidade. Não há ligação em T3. A ligação com as proteínas de transporte aumenta consideravelmente a meia-vida dos hormônios tireoidianos no corpo, porque sua excreção pela urina é significativamente retardada. A meia-vida do T4 é de cerca de cinco a oito dias. No T3, entretanto, leva apenas cerca de 19 horas porque sua ligação ao TBG é muito menor e não está ligado à transtirretina de forma alguma.
A concentração total dos hormônios tireoidianos depende da concentração das proteínas de transporte. No entanto, ao contrário dos hormônios tireoidianos livres, os hormônios tireoidianos ligados não são biologicamente ativos. Os principais locais de produção da transtirretina são o fígado e o plexo coróide. O plexo coróide é uma estrutura vascular arteriovenosa emaranhada nos ventrículos cerebrais.
Anatomia e estrutura
A transtirretina é uma molécula de proteína que consiste em 127 aminoácidos. Sua estrutura secundária, terciária e quaternária é composta por homotetrâmeros. A proteína de transporte pode ser determinada por meio de eletroforese de soro. Aparece antes do pico da albumina, razão pela qual transtirretina também é o nome alternativo Pré-albumina trazido.
A transtiretina tem uma massa molar de 55 kDa. A estrutura química da transtirretina permite que ela se ligue aos hormônios tireoidianos e ao retinol. Como sua concentração diminui nas reações inflamatórias crônicas, também é conhecida como proteína de fase anti-aguda. As proteínas de fase aguda são produzidas em grande parte nas reações inflamatórias. Dessa forma, eles ficam rapidamente disponíveis para o corpo em caso de reações de defesa necessárias. O oposto é verdadeiro para proteínas de fase anti-aguda, como a transtiretina.
Função e tarefas
A principal função da transtirretina é ligar-se aos hormônios tireoidianos e transportá-los. Junto com TBG, garante sua meia-vida mais longa no organismo. Os hormônios da tireoide ficam inativos quando ligados, mas podem ser liberados a qualquer momento, se necessário.
Outra função da transtirretina é ligar-se ao retinol. Ele forma complexos com a proteína de ligação ao retinol. O retinol é vitamina A livre, que desempenha uma variedade de funções no corpo. É responsável pelo processo visual e participa da função da pele, das mucosas, do sistema imunológico, do metabolismo e das células sanguíneas. Os hormônios da tireoide e o retinol são ativos apenas na forma livre. No entanto, a sua ligação a moléculas de transporte, como a transtirretina, evita reações descontroladas dessas substâncias ativas. A liberação controlada da ligação com as proteínas de transporte garante que essas substâncias funcionem adequadamente.
Doenças
Várias mutações da transtirretina podem causar sua deficiência, bem como uma ligação mais forte com os hormônios da tireoide (hipertiroxinemia). Na hipertiroxinemia, os valores totais da glândula tireoide estão aumentados. Mas a concentração de hormônios tireoidianos livres é normal.
Conseqüentemente, a função tireoidiana normal ocorre. Não há sintomas. A hipertiroxinemia às vezes é confundida com hipertireoidismo (glândula tireoide hiperativa). A diferença, entretanto, é que o hipertireoidismo tem uma concentração total aumentada da tireoide e uma concentração maior de hormônios tireoidianos livres. Em conexão com a transtirretina, entretanto, freqüentemente ocorre amiloidose tipo 1 (amiloidose TTR). Muitas vezes, é o resultado de uma falta de transtirretina, que por sua vez é genética.
Na amiloidose, pequenas fibras protéicas que não são mais solúveis são depositadas nos espaços entre as células, o interstício. Essas fibras estão na forma das chamadas fibrilas beta, chamadas de amilóide. Amiloidose não é uma doença independente, mas é um termo coletivo para várias doenças diferentes com processos de deposição patológica. Dependendo da causa, alguns órgãos são afetados pela deposição de fibras protéicas defeituosas. A amiloidose TTR causada pela transtirretina pode envolver coração, sistema nervoso, intestinos, olhos, pulmões ou rins, entre outros.
É possível a insuficiência cardíaca com arritmias cardíacas, distúrbios sensoriais nas mãos e nos pés, diarreia, obstipação, perda de peso ou, em casos raros, lesões renais graves até e incluindo diálise. Como a transtirretina é produzida no fígado, um transplante de fígado pode curar essa forma de amiloidose. O novo fígado saudável sintetiza a transtirretina normal novamente. O processo de deposição é paralisado. Se a doença estiver mais avançada, um transplante de fígado não pode garantir a cura. Uma forma especial de amiloidose TTR é a amiloidose ATTR (amiloidose senil). Esta forma da doença ocorre principalmente na velhice. Aqui, também, a causa pode ser encontrada nas alterações genéticas na transtirretina.
Se não for tratada, a amiloidose leva à morte em poucos anos. Além de um transplante de fígado causal, devem ser realizadas terapias sintomáticas. Isso depende de quais órgãos são particularmente afetados. Se o coração estiver envolvido, diuréticos e inibidores da ECA são administrados. Se ocorrerem arritmias cardíacas, um marca-passo pode ajudar. É importante fazer uma dieta com baixo teor de sal. Se os rins estiverem envolvidos, uma dieta com baixo teor de sal é indicada, inibidores da ECA e diuréticos. A diálise pode ser necessária.




.jpg)



.jpg)
.jpg)