Lisil hidroxilases representam um grupo de enzimas que são responsáveis pela hidroxilação de resíduos de lisina nas proteínas. Portanto, eles contribuem principalmente para a estrutura do tecido conjuntivo. Os distúrbios da função das lisil hidroxilases são expressos em doenças como o escorbuto ou a síndrome de Ehlers-Danlos hereditária.
O que são lisil hidroxilases?
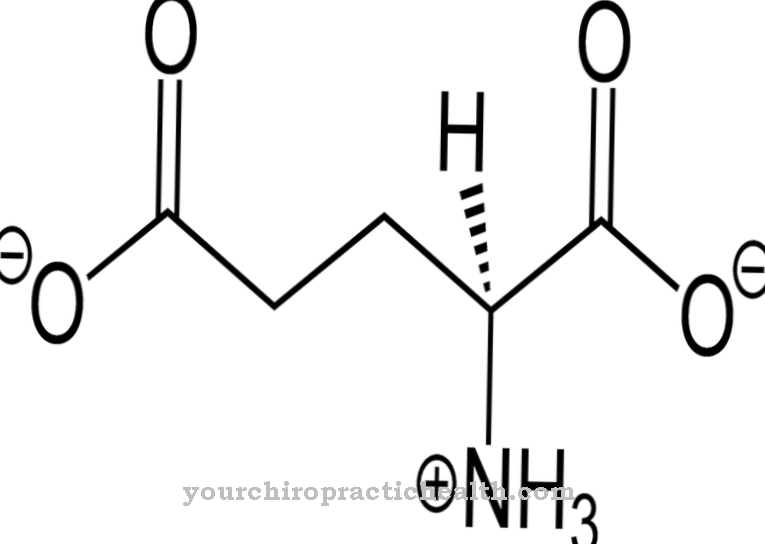
As lisil hidroxilases são enzimas cuja tarefa é catalisar a modificação pós-tradução do aminoácido lisina pela incorporação de um grupo hidroxila na hidroxil lisina. Isso fortalece o tecido conjuntivo porque suas cadeias protéicas têm a oportunidade de se conectar ainda mais por meio dos grupos hidroxila.
A lisil hidroxilase humana consiste em 727 aminoácidos. As lisil hidroxilases também pertencem ao grupo das hidroxilases, isto é, enzimas que geralmente catalisam a incorporação de grupos hidroxil nas moléculas. Além das lisil hidroxilases, as hidroxilases ou oxidorredutases também incluem prolil hidroxilases, fenilalanina hidroxilase, tirosina hidroxilase ou triptofano hidroxilase. Especialmente juntamente com as prolil hidroxilases, as lisil hidroxilases desempenham um papel importante na função do tecido conjuntivo. Ambos os grupos de enzimas requerem a coenzima vitamina C para sua função.
Função, efeito e tarefas
A função das lisil hidroxilases consiste exclusivamente em catalisar a incorporação de grupos hidroxila em resíduos de lisina dentro de uma proteína. No decurso de uma modificação pós-tradução, o aminoácido hidroxilamina é formado a partir da lisina.
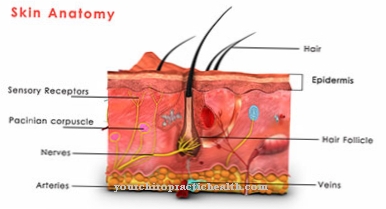
Embora a hidroxilamina também seja gratuita, ela não pode ser incorporada à proteína dessa forma. Modificação pós-tradução significa, portanto, a conversão subsequente deste aminoácido após a proteína ter sido construída. Quando um átomo de hidrogênio é trocado pelo grupo hidroxila, um grupo funcional que pode realizar funções de ponte é incorporado à proteína neste ponto. Com a ajuda do grupo hidroxila, diferentes cadeias de proteínas podem se conectar. Além disso, as moléculas de açúcar podem se ligar a este grupo funcional. Ambas as reações são muito importantes, entre outras coisas, no desenvolvimento do tecido conjuntivo.
O tecido conjuntivo envolve o organismo e os órgãos internos. Ele deve ser firme e tenso para poder diferenciar os órgãos funcionalmente diferentes. Isso é garantido pelas proteínas do tecido conjuntivo, que contêm uma alta porcentagem dos aminoácidos lisina e prolina.Para tal, ambos os aminoácidos são posteriormente parcialmente modificados após a sua incorporação na proteína por adição de um grupo hidroxilo. Como já mencionado, com a prolina esta reação é catalisada por prolil hidroxilases e com lisina por lisil hidroxilases. Após a formação da proteína, essas reações de modificação criam uma rede de cadeias de proteínas que representam o tecido conjuntivo estreito.
Sem a função de ambas as enzimas, o desenvolvimento do tecido conjuntivo funcional não seria possível. No entanto, ambas as enzimas funcionam apenas com a ajuda da coenzima ácido ascórbico, ou seja, vitamina C. Com enzimas estruturalmente alteradas por mutação ou falta de vitamina C, isso pode levar a rupturas na estrutura do tecido conjuntivo e, portanto, a doenças graves.
Educação, ocorrência, propriedades e valores ideais
O gene PLOD1 é responsável pela codificação da lisil hidroxilase humana. O nome PLOD1 é derivado do nome da lisil hidroxilase "procolágeno lisina, 2-oxoglutarato-5-dioxigenase 1". Este gene está localizado no cromossomo 1. Visto que novo tecido conjuntivo está sendo produzido constantemente, há também uma necessidade permanente para a produção de lisil hidroxilases. Uma mutação neste gene pode, portanto, ter consequências muito graves para a saúde do organismo.
Doenças e distúrbios
Os distúrbios na função das lisil hidroxilases desempenham um papel particularmente importante no escorbuto e na síndrome de Ehlers-Danlos. O escorbuto é conhecido como uma doença marítima milenar, causada pela falta de vitamina C. A vitamina C, também conhecida como ácido ascórbico, funciona como uma coenzima de lisil hidroxilases e prolil hidroxilases. Se estiver ausente, os aminoácidos lisina e prolina na proteína do tecido conjuntivo não podem mais ser hidroxilados.
Uma vez que há um constante aumento e quebra de proteínas do tecido conjuntivo, as cadeias de proteínas são cada vez menos capazes de se formarem em rede durante o período de deficiência de vitaminas. O tecido conjuntivo fica frouxo e não pode mais cumprir sua função adequadamente. Uma variedade de sintomas ocorre, incluindo exaustão geral, suscetibilidade a infecções, sangramento nas gengivas, perda de dentes, cicatrização deficiente de feridas, problemas graves de pele, perda de massa muscular e muitos outros problemas de saúde. O escorbuto pode levar à morte por insuficiência cardíaca geral ou infecções graves. Os antigos marinheiros foram particularmente afetados porque não conseguiam obter vitamina C suficiente durante as longas viagens no mar.
Foi demonstrado que a doença cura imediatamente quando certos alimentos, como chucrute, são dados. Só mais tarde foi reconhecido que a causa da doença era uma deficiência de vitamina C. O surto do escorbuto da doença do marinheiro foi mais tarde evitado alimentando-o com chucrute. Outra doença, que só pode ser parcialmente atribuída a um defeito na lisil hidroxilase humana, é a síndrome de Ehlers-Danlos. A síndrome de Ehlers-Danlos é um termo coletivo para várias doenças hereditárias do tecido conjuntivo com diferentes causas. Esta síndrome é caracterizada por grave fraqueza do tecido conjuntivo.
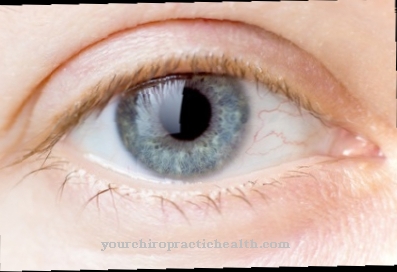
A pele é excessivamente distendida e as articulações, excessivamente móveis. Uma lisil hidroxilase geneticamente modificada desencadeia a síndrome de Ehlers-Danlos tipo VI. Um gene mutado chamado PLOD1, localizado no cromossomo 1, é responsável por isso. A enzima defeituosa formada a partir disso não é mais totalmente funcional e pode apenas catalisar insuficientemente as reações de hidroxilação na lisina. Um tecido conjuntivo fraco se desenvolve com os sintomas conhecidos, bem como envolvimento adicional dos olhos e órgãos internos. A síndrome de Ehlers-Danlos tipo VI pode ser herdada como um traço autossômico recessivo.





.jpg)


.jpg)


.jpg)