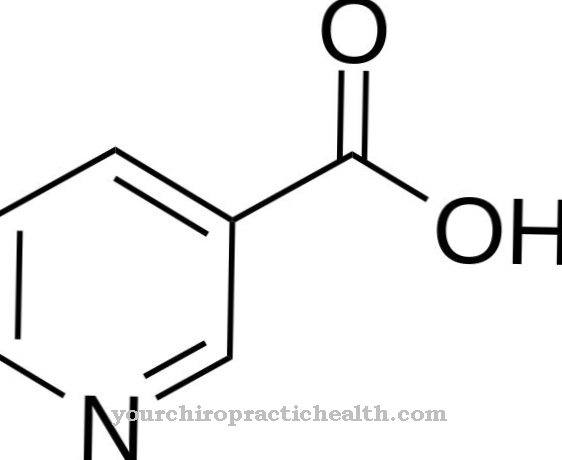
flúor representa um elemento químico com o número atômico 9 e pertence aos halogênios. É um gás fortemente corrosivo, que causa graves danos às membranas mucosas. O flúor é usado medicinalmente na forma de seus sais, o flúor, para fortalecer os dentes.
O que é flúor?
O flúor é um gás altamente cáustico e reativo, não é um composto, mas um elemento químico pertencente aos halogênios. Com o número atômico 9, é o halogênio mais leve. Na natureza, o flúor ocorre principalmente na forma de seus sais, os fluoretos.
O gás flúor não é muito estável e reage com quase todos os compostos e elementos imediatamente após sua produção. Somente com os gases nobres hélio e neon não há reação. Essa reatividade extraordinariamente forte pode ser explicada por sua afinidade muito forte pelos elétrons. Ele sempre retira elétrons de seus parceiros de reação e, portanto, é o agente oxidante mais forte. O nome flúor é derivado do latim "fluores" (rio). Como fluoreto de cálcio (espatoflúor), serve como fundente para os minérios.
Quando o espatoflúor é adicionado aos minérios, ele diminui seu ponto de fusão para que se tornem líquidos mais rapidamente. Do ponto de vista conceitual, na medicina existe o termo genitália flúor para a descarga incruenta de secreção da genitália feminina. No entanto, o flúor genital não deve ser confundido com o elemento flúor.
Função, efeito e tarefas
O flúor é chamado de oligoelemento essencial. No entanto, a importância do flúor é controversa. Sabe-se que os fluoretos possuem propriedades protetoras contra os dentes. O flúor pode fortalecer os dentes e, ao mesmo tempo, inibir certas enzimas da bactéria cárie, que causam a quebra dos carboidratos.
Os fluoretos atuam diretamente no dente. A ingestão oral de flúor não tem efeito nos dentes. Os dentes consistem principalmente do mineral hidroxiapatita. A hidroxiapatita pode ser atacada por ácidos que são produzidos pela quebra de resíduos alimentares. A má higiene dental, portanto, geralmente resulta em buracos nos dentes que ainda estão ocupados por bactérias da cárie. Por exemplo, se o creme dental contém flúor, há uma troca de íons hidroxila por íons de flúor. Isso cria fluorapatita, que acaba sendo um material mais duro e menos vulnerável a ácidos. Mesmo a hidroxiapatita dissolvida por ácidos pode ser precipitada novamente como fluoroapatita na presença de fluoretos.
Uma destruição inicial pode então ser revertida. Mas os fluoretos também têm propriedades positivas para a construção de ossos. Aqui, a ingestão é feita por via oral. Crianças e bebês recebem flúor e vitamina D para prevenir o raquitismo. No entanto, o flúor não deve ser sobredosado, para que a fluorose com endurecimento e espessamento das articulações não se desenvolva. Os compostos de flúor também são aprovados como medicamentos para a osteoporose. Os comprimidos correspondentes contêm fluoreto de sódio ou fluorofosfato dissódico.
Educação, ocorrência, propriedades e valores ideais
O flúor está contido na forma de fluoretos no chá preto e verde, espargos e também em peixes. Muitos sais contêm flúor. Não existem sais de flúor puros devido à baixa solubilidade dos compostos contendo flúor na água. O fluorapatita (fluoreto de cálcio) e a fluorapatita são mais comuns na crosta terrestre.
O flúor é feito principalmente de fluoreto de cálcio. Existem até organismos que podem produzir compostos organofluorados. O Gifblaar sul-africano ou plantas do gênero Dichapetalum podem sintetizar ácido fluoroacético contra predadores. O organismo humano tem uma necessidade diária de 0,25-0,35 mg.
Doenças e distúrbios
No entanto, intoxicações relacionadas ao flúor e problemas de saúde são mais comuns. Como mencionado anteriormente, o flúor puro é um gás corrosivo muito venenoso. É isso também que torna difícil fazer flúor.
Como reage com quase todos os materiais, também pode ser mal armazenado e transportado. Quando envenenado com flúor, queimaduras químicas e queimaduras ocorrem nos pulmões, na pele e nos olhos. Dependendo da dose, os órgãos relevantes se dissolvem em um curto espaço de tempo, resultando em morte. A dose letal é muito baixa e é de 185 ppm. O envenenamento por flúor com flúor puro raramente ocorrerá porque o gás não é estável. No entanto, o envenenamento por fluoreto de hidrogênio é igualmente perigoso. O fluoreto de hidrogênio forma ligações de hidrogênio com as proteínas do corpo, por meio das quais a estrutura terciária das proteínas é destruída. Ocorre uma desnaturação da proteína corporal.
Os fluoretos podem formar compostos complexos com íons de alumínio que têm um efeito semelhante aos fosfatos. No corpo, esses compostos intervêm nas reações de fosforilação. Entre outras coisas, isso leva à desregulação das proteínas G, por meio da qual muitas enzimas são inibidas. Só por esse motivo, uma dose elevada de flúor não é tolerada pelo organismo. Tomar muitos comprimidos de flúor também pode causar náuseas, vômitos e diarreia. O fluoreto reage com o ácido gástrico, formando uma pequena quantidade de ácido fluorídrico. Isso ataca as membranas mucosas. Uma overdose leve e crônica de flúor pode causar fluorose.
A fluorose é o envenenamento crônico por flúor com alterações na estrutura do esmalte dos dentes, tosse, expectoração e falta de ar. O excesso de hidroxiapatita se transforma em fluoroapatita nos dentes. Os dentes ficam mais quebradiços. Os ossos também mudam devido à formação excessiva de fluorapatita. Os ossos endurecem lentamente e se remodelam. Além disso, a enzima enolase é inibida.

.jpg)







.jpg)
.jpg)


.jpg)