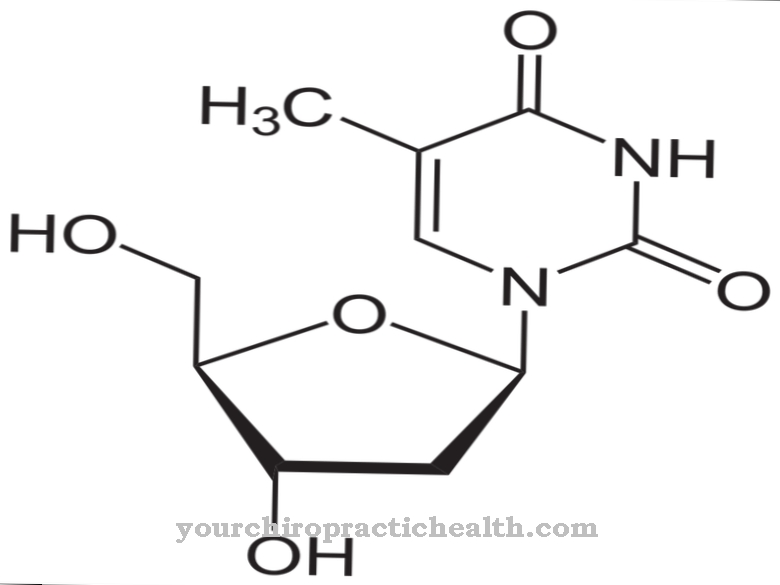
Hidroxilisina é um aminoácido proteinogênico não clássico. É incorporado na proteína correspondente como lisina e hidrolisado em hidroxilisina dentro do polipeptídeo com a ajuda de uma enzima. É um dos principais componentes das proteínas do colágeno no tecido conjuntivo.
O que é hidroxilisina?
A hidroxilisina é um aminoácido proteinogênico que é incorporado pela primeira vez em uma proteína como lisina. Portanto, é um aminoácido proteinogênico não canônico. O termo "canônico" significa clássico.
Portanto, não há códon para este aminoácido. A hidroxilisina é encontrada principalmente no colágeno do tecido conjuntivo e nas glicoproteínas. Lá, a lisina é convertida em hidroxilisina por meio de processos enzimáticos. Apenas parte da lisina é convertida em hidroxilisina. As propriedades dos respectivos colágenos dependem da quantidade de resíduos de lisina e prolina hidrolisados.
A hidroxilisina pode ser isolada na forma livre como o cloridrato. O cloridrato de hidroxilisina é um pó bege com ponto de fusão de 225 a 230 graus. É um aminoácido básico que também torna básicas as proteínas contendo hidroxilisina. A hidroxilisina foi descoberta pelo bioquímico americano e co-fundador da "Química Clínica" Donald Van Slyke (1883-1971).
Função, efeito e tarefas
A hidroxilisina é de grande importância para a estrutura do tecido conjuntivo. As glicoproteínas também contêm hidroxilisina para formar compostos glicosídicos da proteína com resíduos de açúcar no resíduo de hidroxila.
Dentro do colágeno, é responsável pela ligação cruzada das moléculas de proteína individuais. Junto com a hidroxilprolina, a forma hidrolisada da prolina, também é fundamental na construção das estruturas terciária e quaternária do colágeno. A hidroxilação da lisina é catalisada pela enzima lisil hidroxilase com a participação dos cofatores íons ferro e ácido ascórbico (vitamina C). O padrão de distribuição dos resíduos de lisina hidroxilada no colágeno não é nem particularmente rígido nem flexível. Sempre existem padrões recorrentes.
No entanto, também existem áreas inteiras dentro da proteína que não contêm quaisquer resíduos de lisina hidroxilada. Enquanto a hidroxiprolina é responsável pela estrutura helicoidal do colágeno através da ligação de três cadeias de proteínas, as ligações cruzadas entre as várias moléculas de proteína são formadas por meio dos grupos hidroxila da hidroxilisina. Além disso, esses grupos moleculares também servem como um local de ligação para uma ligação glicosídica com um açúcar. No geral, isso garante a resistência do tecido conjuntivo.
Se houver uma deficiência de hidroxilisina nas proteínas, isso não pode ser remediado por uma ingestão adicional do aminoácido. Não há códon para a hidroxilisina livre, de modo que ela não pode ser incorporada na proteína correspondente. O valor dos suplementos dietéticos com hidroxilisina adicionada é, portanto, muito questionável. Portanto, a deficiência deve ser devido à hidroxilação insuficiente da lisina.
Educação, ocorrência, propriedades e valores ideais
A hidroxilisina é encontrada apenas no colágeno humano e animal. Existem também algumas glicoproteínas que também contêm hidroxilisina. Isso inclui a adiponectina. A adiponectina é um hormônio produzido no tecido adiposo e tem influência decisiva na eficácia da insulina. A hidroxilisina também foi detectada em algumas bactérias, como Staphylococcus aureus.
A distribuição da lisina hidroxilada não é uniforme no colágeno. Existem locais onde quase sempre é encontrado. Em outras áreas, a hidroxilisina quase nunca é encontrada. Essa distribuição desigual determina a estrutura do colágeno. Dentro da estrutura de hélice tripla do colágeno, a hidroxilisina está sempre localizada na posição Y da sequência de repetição Gly-X-Y. Nas regiões curtas com estrutura não helicoidal, a hidroxilisina também ocorre em outros locais.
Doenças e distúrbios
O tecido conjuntivo é absolutamente dependente da presença de hidroxilisina. O colágeno só pode ser estável e firme se as ligações cruzadas entre as moléculas de proteína funcionarem. A deficiência de hidroxilisina causa fraqueza do tecido conjuntivo.
Se estiver presente apenas em quantidades extremamente pequenas ou não estiver presente, o organismo correspondente não seria viável. O tecido conjuntivo não poderia mais desempenhar sua função de tecido limitante e de suporte dos órgãos. Na verdade, existem doenças que podem ser atribuídas à falta de hidroxilisina. Uma vez que este aminoácido é inicialmente incorporado como lisina durante a síntese de proteínas, ele não pode ser uma deficiência primária. A hidroxilisina é formada a partir da lisina na proteína do colágeno com a ajuda das lisil hidroxilases. Uma deficiência de hidroxilisina só pode resultar de um defeito nesta enzima ou de sua função insuficiente.
Existe um grupo de fraquezas do tecido conjuntivo congênito heterogêneo conhecido como síndrome de Ehlers-Danlos. Várias mutações podem ser responsáveis por esse quadro clínico. Entre outras coisas, a lisil hidroxilase também pode ser defeituosa, de modo que muito pouca lisina é hidroxilada. A síndrome de Ehlers-Danlos se manifesta por meio da hiperextensão da pele e da hipermobilidade das articulações. Órgãos internos, vasos sanguíneos, tendões, ligamentos e músculos também são afetados. O prognóstico depende da gravidade do defeito. Se as embarcações estiverem envolvidas, é de se esperar um curso desfavorável. A falha completa da enzima lisil hidroxilase é incompatível com a vida e, portanto, não é observada.
Mas mesmo com uma enzima intacta, pode haver tecido conjuntivo fraco devido à sua baixa atividade. A lisil hidroxilase requer íons de ferro e ácido ascórbico (vitamina C) como cofatores. Se, por exemplo, falta vitamina C, ocorre o que é conhecido como escorbuto. O escorbuto é uma doença adquirida do tecido conectivo, causada pela falta de grupos hidroxila nos resíduos de prolina e lisina do colágeno. A causa é a baixa atividade da prolina hidroxilase e lisina hidroxilase devido à deficiência de ácido ascórbico.




.jpg)


.jpg)